Sole mineralne dają tkanka kostna wytrzymałość, sztywność. Zarówno podwyższona jak i obniżona zawartość soli mineralnych w tkance kostnej obniża jej cechy wytrzymałościowe. U dzieci niewystarczająca mineralizacja tkanki kostnej utrudnia wzrost kości kanalikowych, prowadząc do ich skrzywienia. Niewystarczająca mineralizacja ma negatywny wpływ na siłę kości i w wieku dorosłym.
Przy nadmiarze soli mineralnych tkanka kostna staje się krucha, jej wytrzymałość znacznie się zmniejsza.
Rozpuszczalne w wodzie kwasy i sole znajdują się w organizmie w formie zjonizowanej. Spośród kationów najwyższa jest zawartość jonów Na + , K + , Ca 2+ , Mg 2+ , Zn 2+ , Fe 3+ , Fe 2+. Zn 2+ , Ni 2+ , Cr 3+ , Mn 2+ , Cd 2+ , Ba 2+ , Cu 2+ , Co 2+ , Mo 2+ i niektóre inne jony metali zawarte są w znacznie mniejszych ilościach. Ze względu na niską zawartość w organizmie jony te nazywane są pierwiastkami śladowymi.
Spośród anionów najszerzej reprezentowane są reszty kwasowe kwasu węglowego, chlorowodorowego i fosforowego. Anion kwasu siarkowego zawarty jest w znacznie mniejszych ilościach.
Jony mogą znajdować się zarówno w stanie wolnym, jak i związanym w składzie różnych związków organizmu. Funkcje wolnych i związanych jonów są różne. Jony określają ciśnienie osmotyczne płynów biologicznych, tworzą potencjał elektryczny błon komórkowych, zapewniają tworzenie i przekazywanie impulsów nerwowych, działają jako aktywatory, kofaktory lub składniki enzymów i innych związków biologicznie czynnych.
Zajmijmy się bardziej szczegółowo zawartością i rolą poszczególnych jonów w organizmie.
jony wapnia. Jony wapnia znajdują się zarówno we krwi, jak iw komórkach organizmu. Zawartość Ca 2+ we krwi wynosi około 5,7 mg% (5,7 mg na 100 ml krwi). Jest nierównomiernie rozłożony pomiędzy plazmą a formowanymi elementami. Erytrocyty zawierają go około 1,0 mg%, leukocyty - około 4,0-5,0 mg%. W osoczu krwi stężenie wapnia jest wyraźnie wyższe.
W komórkach organizmu wapń zlokalizowany jest głównie w mitochondriach, siateczce sarkoplazmatycznej i rybosomach.
Jony wapnia aktywują funkcję fagocytarną leukocytów, zwiększają odporność organizmu na infekcje i zatrucia, zmniejszają przepuszczalność naczyń włosowatych, dzięki czemu działają przeciwzapalnie i przeciwalergicznie. Normalizują pobudliwość obwodowego układu nerwowego, stymulują aktywność współczulnego układu nerwowego. Bardzo ważna rola Jony wapnia odgrywają rolę w sprzężeniu pobudzenia ze skurczem mięśnia sercowego i szkieletowego.
Nie ogranicza się to do roli jonów wapnia w organizmie. Wchodzą w skład błon komórkowych, zapewniając ich stabilizację, uczestniczą w synaptycznej transmisji impulsów nerwowych, są regulatorami aktywności wielu enzymów. Jony wapnia są niezbędne do realizacji czynności wielu gruczołów dokrewnych (przysadka mózgowa, nadnercza), gruczołów układ trawienny. Biorą czynny udział w procesach krzepnięcia krwi.
Jony Na+ i K+. Wartość jonów sodu w organizmie jest niezwykle wysoka. Jony Na + są głównymi jonami w osoczu krwi i płynie pozakomórkowym. Odgrywają ważną rolę w utrzymaniu równowagi wodnej organizmu człowieka. Zawartość jonów sodu w organizmie determinuje objętość płynu (wody), a każde naruszenie jego metabolizmu natychmiast prowadzi do redystrybucji, retencji lub utraty wody.
Stężenie jonów sodu w płynach ustrojowych jest czynnikiem wpływającym na aktywność niektórych enzymów, w szczególności enzymów przemian beztlenowych węglowodanów, a także enzymów magazynujących energię w makroergicznych związkach fosforanowych.
Brak sodu prowadzi do szeregu zaburzeń w organizmie: tkanki są odwodnione, zaburzone jest krążenie krwi, utrata apetytu i osłabienie zdolności umysłowych. Wszystkie te zaburzenia w większości przypadków nie wynikają z braku soli (głównego źródła sodu i chloru dla organizmu) w pożywieniu, ale z jej dużych ubytków w określonych stanach i chorobach: wymiotach, biegunkach, nadmiernej potliwości.
Jony sodu pełnią ważne funkcje w utrzymaniu równowagi kwasowo-zasadowej w organizmie. To działanie przejawia się w szczególności w nerkach. W kanalikach nerkowych jony sodu są ponownie wchłaniane w zamian za wydzielane jony wodorowe. W ten sposób zapewnione jest zachowanie stałego pH podczas tworzenia kwaśnych metabolitów i zachowanie jonów sodu w organizmie. Ta zdolność w nerkach jest tak wysoka, że stosunek stężeń jonów wodorowych w moczu i krwi może sięgać nawet 800:1.
Ponieważ głównym źródłem sodu dla organizmu jest sól kuchenna, zwykle mówi się, że potrzebna jest sól kuchenna, a nie sód. U osoby dorosłej zapotrzebowanie na sól kuchenną wynosi 4-5 g dziennie. Zwiększone zapotrzebowanie na sól kuchenną może wiązać się z niektórymi chorobami, a także zwiększoną potliwością, w której traci się wiele jonów sodu. Powoduje to zwiększone zapotrzebowanie na sól u sportowców. Szczególnie wysokie jest zapotrzebowanie na sól u osób uprawiających sporty, w których trening i aktywność wyczynowa wiążą się z obfitym poceniem się.
W przeciwieństwie do sodu, jony potasu znajdują się głównie w komórkach narządów i tkanek. Całkowita ilość potasu w organizmie człowieka ważącym 70 kg wynosi około 140 g. Z tej ilości tylko około 25 g znajduje się w przestrzeni pozakomórkowej. Najwyższa zawartość jonów potasu w erytrocytach, włóknach mięśniowych, komórkach wątroby.
Większość wewnątrzkomórkowego potasu jest związana z białkami, węglowodanami, fosforanami, fosforanem kreatyny. Wiele procesów syntezy w organizmie wymaga obecności jonów potasu. Tak więc potas bierze udział w syntezie glikogenu. Przy zwiększonej glukoneogenezie w wątrobie i mięśniach obserwuje się spadek stężenia wolnych jonów potasu. Wręcz przeciwnie, przy intensywnym rozpadzie glikogenu, np. podczas intensywnej pracy mięśni, wyraźnie wzrasta stężenie wolnych jonów potasu.
Wiązanie jonów potasu obserwuje się podczas syntezy białka, ATP, fosforanu kreatyny. Tak więc podczas syntezy każdych 2 g białka wiąże się około 1 milirównoważnika jonów potasu. Wraz z niedoborem potasu w organizmie synteza tych związków zostaje zakłócona.
Potas bierze czynny udział w przekazywaniu impulsów nerwowych w formacjach synaptycznych, bierze udział w syntezie acetylocholiny, mediatora pobudzenia nerwowego. Potas wraz z jonami sodu bierze udział w polaryzacji błony komórkowej i wzbudzeniu komórki, zapewniając skurcz mięśni.
Jony potasu biorą udział w regulacji czynności serca. Serce jest bardzo wrażliwe na wahania stężenia potasu we krwi. Działa również rozszerzająco na naczynia krwionośne.
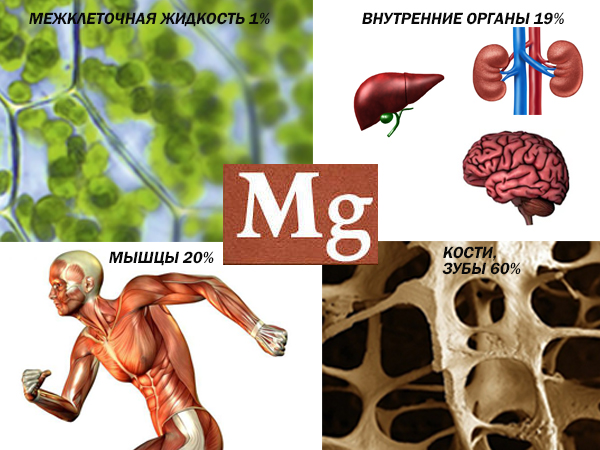
Jony magnezu. Całkowita ilość magnezu w organizmie człowieka ważącym 70 kg wynosi około 14,4 g. Największa zawartość magnezu występuje w tkance kostnej, gdzie występuje w postaci soli fosforanowych, węglowych i fluorkowych. Popiół kostny zawiera do 1,5% magnezu. Tkanka kostna zawiera pewną ilość rozpuszczalnych w wodzie soli magnezowych, które tworzą swego rodzaju skład ciała. Niedobór soli magnezu w tkance kostnej powoduje opóźnienie ich wzrostu na długość i grubość.
Magnez wchodzi w skład krwi, mięśni, wątroby, nerek oraz innych narządów i tkanek, pełniąc tam różne i ważne funkcje. Jest aktywatorem szeregu enzymów: cholinoesterazy, fosfoglukomutazy, pirofosfatazy, arginazy, karboksylazy, dipeptydazy jelitowej. Magnez jest niezbędny w syntezie acetylocholiny, do wystąpienia glikolizy, w syntezie białek, tworzeniu i rozpadzie ATP. Bierze udział w skurczu mięśni, regulacji czynności serca. Liczne badania wykazały odwrotną zależność między śmiertelnością z powodu chorób serca a zawartością zjonizowanego magnezu w organizmie, a także w wodzie pitnej jako głównym źródle magnezu dla organizmu.
Poza wymienionymi już, magnez pełni w organizmie człowieka inne funkcje, a jego niedobór lub nadmiar może powodować poważne zaburzenia. Tak więc magnez jest niezbędny do wchłaniania produktów trawiennych w przewodzie pokarmowym. Jednak nadmiar magnezu zmniejsza szybkość wchłaniania niektórych z nich, w szczególności kwasów tłuszczowych, ze względu na tworzenie z nimi nierozpuszczalnych kompleksów.
Niedobór magnezu prowadzi do znacznej zmiany składu mineralnego komórek, do wzrostu stężenia trójglicerydów we krwi, stłuszczenia wątroby, zwapnienia naczyń krwionośnych i zmniejszenia ich zawartości elastyny. Niedobór magnezu powoduje martwicę i ogniska zwapnień w mięśniu sercowym, przekrwienie błon śluzowych oczu, nosa, ust, wypadanie włosów, drgawki, a ostatecznie może prowadzić do śmierci organizmu.
Jony chloru. Zawartość chloru w organizmie człowieka o wadze 70 kg wynosi około 88,7 g. Jony chloru są głównymi anionami w osoczu krwi, stanowią około 75% całkowitej ilości anionów we krwi. Podobnie jak jony sodu, jony chlorkowe biorą udział w utrzymaniu ciśnienia osmotycznego osocza krwi i innych płynów biologicznych. W związku z tym zawartość wody w organizmie oraz poszczególnych narządach i tkankach w dużej mierze zależy od stężenia jonów chlorkowych. Nadmiarowi jonów chlorkowych towarzyszy zwiększona zawartość wody, niedobór prowadzi do utraty wody.
Jony chloru biorą udział w detoksykacji organizmu poprzez wiązanie toksycznych produktów przemiany materii. W szczególności biorą udział w usuwaniu jonów amoniaku i wodoru z organizmu przez nerki. Część amoniaku powstałego w komórkach organizmu w procesie deaminacji aminokwasów i innych związków zawierających azot jest dostarczana do nerek przez kwas glutaminowy lub asparaginowy. Tam jest odcinany od wskazanych aminokwasów i łączony z jonami chlorkowymi i wodorowymi, tworząc chlorek amonu (NH 4 Cl), który jest wydalany z organizmu wraz z moczem. Jednocześnie jony wodorowe są wiązane i usuwane z organizmu, co zapewnia utrzymanie równowagi kwasowo-zasadowej organizmu. Reakcja przebiega zgodnie z równaniem:
NH3 + H + + Cl¯ → NH4 Cl
Chlor dostaje się do organizmu głównie w połączeniu z sodem (jako część soli kuchennej). Wspomniane wcześniej zapotrzebowanie na sól kuchenną zaspokaja zapotrzebowanie organizmu ludzkiego zarówno na sód, jak i na chlor.
Mikroelementy. Oprócz powyższego organizm człowieka zawiera szereg jonów w niewielkich stężeniach (nieprzekraczających 0,001%) Należą do nich: Fe 2+ , Zn 2+ , Mn 2+ , Mo 2+ , Co 2+ , J‾ i kilka innych. Ze względu na niską zawartość w organizmie nazywane są pierwiastkami śladowymi. Funkcje pierwiastków śladowych w ludzkim ciele są zróżnicowane, chociaż rola niektórych z nich nie została jeszcze dostatecznie zbadana. Zastanówmy się nad rolą niektórych pierwiastków śladowych.
Jony żelaza są częścią hemoglobiny i mioglobiny we krwi zawartych w tkance mięśniowej, innych tkankach i narządach. Jony Fe 2+ biorą udział w dostarczaniu tlenu do tkanek, zapewniając jego przejście z krwi do tkanek i odkładanie się w nich. Ponadto jon żelaza wchodzi w skład enzymów utleniania tlenowego (cytochromów), a także katalazy, enzymu rozkładającego nadtlenek wodoru powstający w procesach utleniania biologicznego.
Intensywnej aktywności mięśniowej towarzyszy znaczny wzrost metabolizmu energetycznego, a w konsekwencji wzrost rozkładu związków zawierających żelazo biorących udział w jego dostarczaniu, ogólny wzrost metabolizmu żelaza. Jednocześnie stopień wchłaniania żelaza z pożywienia jest bardzo niski. W efekcie w okresie intensywnego treningu mogą wystąpić stany niedoboru żelaza w organizmie i konieczność stosowania preparatów zawierających związki żelaza jako dodatkowych czynników żywieniowych.
Jony cynku są częścią wielu enzymów biorących udział zarówno w reakcjach syntezy, jak i procesach katabolicznych. Są niezbędne w procesach przenoszenia informacji genetycznej w komórce, do syntezy hemoglobiny. Jony cynku biorą udział w stabilizacji struktury niektórych makrocząsteczek, procesach wzrostu organizmu, aktywności układu odpornościowego, procesach gojenia ran, rozwoju mózgu u płodu oraz stymulują funkcje hormonalne trzustki.
Jony manganu biorą udział w metabolizmie glukozaminoglikanów wchodzących w skład tkanki łącznej, glukozy, glikogenu i lipidów. Odgrywają szczególnie ważną rolę w metabolizmie w mózgu. Przy braku manganu zaburzony jest metabolizm w tkance łącznej, mózg, zmniejsza się tempo syntezy glikogenu.
Mechanizm działania jonów manganu pod wieloma względami nie jest jeszcze jasny, do tej pory jednoznacznie wykazano jedynie jego rolę jako kofaktora wielu enzymów, w szczególności glikozylotransferaz.
Kobalt bierze udział w erytropoezie (syntezie hemoglobiny) i regulacji metabolizmu żelaza w organizmie. Odgrywa ważną rolę w regulacji lipidów we krwi oraz niektórych reakcjach metabolicznych zachodzących w sercu, tkance nerwowej i ścianach przewodu pokarmowego.
Jony miedzi, niklu, chromu i innych pierwiastków śladowych pełnią w organizmie ważne funkcje. Miedź bierze więc udział w tworzeniu flawoprotein i oksydazy cytochromowej - enzymów metabolizmu energetycznego, działa aktywująco na glikolizę. Niektóre pierwiastki śladowe są integralną częścią nie tylko enzymów, ale także hormonów. Jod jest więc strukturalnym składnikiem hormonów tarczycy: tyroksyny i trójjodotyroniny.
Magnez jest jednym z najważniejszych i niezbędnych pierwiastków śladowych dla ludzkiego organizmu. A w okresie rodzenia dziecka potrzeba tego wzrasta kilkakrotnie. Jest to ważne zarówno dla prawidłowego funkcjonowania organizmu matki i pomyślnej ciąży, jak i dla prawidłowego wzrostu i rozwoju dziecka.
Ten pierwiastek śladowy bierze udział w wielu procesach metabolicznych, przyczynia się do prawidłowego funkcjonowania układu mięśniowego, kostnego, nerwowego i odpornościowego. Dlatego jej niedobór dla kobiety w ciąży może grozić poważnymi konsekwencjami.
Jaka jest rola magnezu?
Magnez bierze udział w wielu procesach metabolicznych w organizmie. Przyczynia się do normalizacji procesu przekazywania impulsów nerwowych w tkance mięśniowej, rozluźnia mięśnie, zmniejsza ich nadmierne napięcie, uspokaja układ nerwowy.
Często kobiecie przepisuje się dodatkowe spożycie magnezu na etapie przygotowania do poczęcia. Udowodniono, że magnez promuje i reguluje transfer materiału genetycznego od rodziców do dzieci. Jon Mg 2+ bierze udział w syntezie składników strukturalnych DNA.
Ten mikroelement bierze również czynny udział w syntezie białek, które są bezpośrednio budulcem narządów wewnętrznych i układów dziecka.
Magnez bierze również udział w pełnym funkcjonowaniu łożyska przez całą ciążę, regulując za jego pośrednictwem metabolizm między organizmami matki i dziecka.
Dlaczego niedobór magnezu jest niebezpieczny dla kobiet w ciąży?
Niedobór magnezu (hipomagnezemia) może powodować powstawanie defektów w okruchach Rozwój prenatalny układ mięśniowo-szkieletowy lub serce. Niedobór magnezu może prowadzić do przedwczesnego porodu lub groźby poronienia.
Na późniejsze daty a podczas porodu magnez jest tak samo ważny dla kobiety w ciąży, jak przez cały okres ciąży. Brak tego mikroelementu prowadzi do zmniejszenia elastyczności włókien mięśniowych i naruszenia ich kurczliwości, co może przyczynić się do naruszenia aktywności zawodowej (osłabienie, brak koordynacji pracy). W efekcie wzrasta ryzyko urazu i pęknięcia kanału rodnego matki.
Zapotrzebowanie na magnez w czasie ciąży wzrasta o około 30%. W końcu teraz potrzebują tego dwa organizmy - matka i dziecko.
Uzupełnienie niedoboru wszelkich substancji niezbędnych dziecku w okresie ciąża nadchodzi z rezerw ciała matki. Dlatego jasne jest, że przyszła mama może czasami mieć oczywiste oznaki braku pierwiastków śladowych.
Jeśli do organizmu z pokarmem dostanie się niewystarczająca ilość magnezu, to organizm pobiera go z kości, zębów i gruczołów dokrewnych. Próbuje więc zrekompensować początkowy spadek poziomu magnezu w osoczu krwi.
Dlatego to takie ważne przyszła mama zapobiegać stanom niedoboru magnezu na każdym etapie – od planowania ciąży po sam poród.
Jak określić brak magnezu w organizmie?
Objawy obserwowane u kobiet w ciąży z niedoborem magnezu:
OD skurcz mięśni
Często przy braku magnezu przyszła mama martwi się bólem dolnej części pleców i kończyn dolnych. W szyi występuje sztywność mięśni i dyskomfort.
Niedobór magnezu objawia się również napięciem (skurczem) mięśni macicy. Kobiety opisują ten stan jako „żołądek sztywnieje”, „żołądek mimowolnie napina się”. W tym przypadku pojawia się skurczowy ból w dolnej części brzucha. Taki zwiększony ton macicy może prowadzić do przerwania ciąży.
Innym przejawem zaburzonego skurczu mięśni przy niedoborze magnezu są skurcze mięśni łydek. Ostry, uporczywy, bardzo bolesny skurcz mięśni łydek występuje głównie w nocy. Stan jest dość nieprzyjemny, bolesny.
Musisz zrozumieć, że skurcze kończyn dolnych mogą wskazywać nie tylko na brak magnezu, ale także na niedobór wapnia w ciele kobiety w ciąży.
Zmiany w układzie nerwowym
W czasie ciąży zmienia się stan psycho-emocjonalny każdej kobiety. Istnieją obawy o zdrowie dziecka i własne samopoczucie. A przy braku magnezu nasilenie nerwowości, nieuzasadniona drażliwość, zaburzenia snu, labilność emocjonalna, płaczliwość i obniżona wydajność znacznie wzrasta.
Zmiany w układzie sercowo-naczyniowym
Niedobór magnezu objawia się wzrostem ciśnienie krwi. Jednocześnie do wysokiego ciśnienia dołączają zawroty głowy i bóle głowy. Na tle zwiększonego ciśnienia zaburzony jest odpływ żylny z kończyn dolnych, co objawia się obrzękiem nóg.
Przy wyraźnym braku jonów magnezu przewodzenie w sercu może być zaburzone wraz z rozwojem arytmii i występowaniem bólu w okolicy serca.
Spadek poziomu magnezu w surowicy krwi poniżej 0,7 mmol/l wskazuje na niedobór tego pierwiastka śladowego. W tym stanie wymiana elektrolitów (sód, potas, magnez) jest zaburzona podczas skurczu mięśnia sercowego (mięśnia sercowego).
Przy braku magnezu w organizmie zaburzony jest również rozluźnienie mięśniowej ściany naczyń. W rezultacie, z powodu stałego umiarkowanego skurczu naczyń, przepływ krwi do końcowych części ciała jest mniejszy niż zwykle. Dlatego osoby z niedoborem magnezu stają się bardziej wrażliwe na zimno, nawet latem robią się chłodno.
Zmiany w układzie pokarmowym
Brak magnezu powoduje naruszenie kurczliwości jelita, czyli jego perystaltyki. Dlatego zaparcia i wzdęcia są częstymi towarzyszami takiego niedoboru.
Cechy żywienia z brakiem magnezu
Magnez jest wchłaniany z pokarmów w jelicie, głównie w jego cienkiej, ale częściowo w grubej części. Ale niestety tylko 35% magnezu jest wchłaniane z pokarmów przez przewód pokarmowy.
Co można zrobić, aby wchłonąć więcej niż 35% magnezu? Jego wchłanianie poprawia witamina B 6 i niektóre kwasy organiczne (mlekowy, cytrynowy, asparaginowy).
Ważne jest również, w jakiej formie magnez dostaje się do organizmu. Tak więc jego związki organiczne, na przykład cytrynian magnezu (związek magnezu z kwasem cytrynowym), mleczan magnezu (związek magnezu z kwasem mlekowym), są dobrze wchłaniane przez jelita. ALE sole nieorganiczne praktycznie nie wchłaniany, na przykład siarczan magnezu.
Aby zapobiec niedoborowi magnezu u kobiety w ciąży, konieczne jest włączenie do diety produktów bogatych w magnez. Należą do nich: pietruszka, koperek, orzechy, rośliny strączkowe, ryby i owoce morza, płatki owsiane i gryczane, arbuz, żółtko jajka, soja, otręby, banany, koper włoski, pieczywo pełnoziarniste.

Dużo magnezu znajduje się we wszystkich zielonych pokarmach roślinnych. Zielony kolor Daje roślinom chlorofil. To szczególna substancja, złożone białko, dzięki któremu rośliny przeprowadzają bardzo ważny proces fotosyntezy.
Struktura chemiczna chlorofilu jest podobna do hemoglobiny białka krwi ludzkiej. Tylko hemoglobina zawiera jony żelaza, a chlorofil zawiera jony magnezu. Dlatego jedz więcej zielonych warzyw i owoców. To najważniejsze źródła magnezu dla organizmu człowieka.
Ale najbogatsze w magnez nadal nie są zielone pokarmy. Poniżej znajduje się tabela liderów żywności pod względem zawartości magnezu w 100 g produktu. Zobacz, który z tych produktów jest dla Ciebie najbardziej odpowiedni do uzupełnienia zapasów magnezu w organizmie.
| Nazwa produktu | Zawartość magnezu, mg/100 g części jadalnej produktu |
|---|---|
| Nasiona dyni | 534 |
| otręby pszenne | 448 |
| Kakao 20% | 442 |
| Sezam (prażone nasiona) | 356 |
| Nerkowiec (surowy) | 292 |
| Migdały (pieczone) | 286 |
| Orzechy sosnowe | 251 |
| Soja (sucha fasola) | 240 |
| Kiełki pszenicy, surowe | 239 |
| Kasza Gryczana (surowa) | 231 |
| Arbuz | 224 |
| Płatki kukurydziane | 214 |
| Płatki owsiane | 130 |
| Nasiona słonecznika (prażone) | 129 |
| Groch obrany | 128 |
| Dzika róża (sucha) | 120 |
| orzech włoski | 100 |
Przyjrzyjmy się teraz, jakie czynniki zaburzają wchłanianie magnezu lub przyczyniają się do wyczerpywania jego rezerw w organizmie.
- napoje z kofeiną;
- monotonna dieta z nadmiarem łatwo przyswajalnych węglowodanów i słodyczy;
- słodkie napoje gazowane;
- alkohol, palenie;
- przewlekły ból lub stres;
- choroby endokrynologiczne: niedoczynność tarczycy, cukrzyca;
- choroby, którym towarzyszy zwiększona potliwość;
- przyjmowanie niektórych leków (diuretyków, leków przeciwdrgawkowych, soli wapnia).
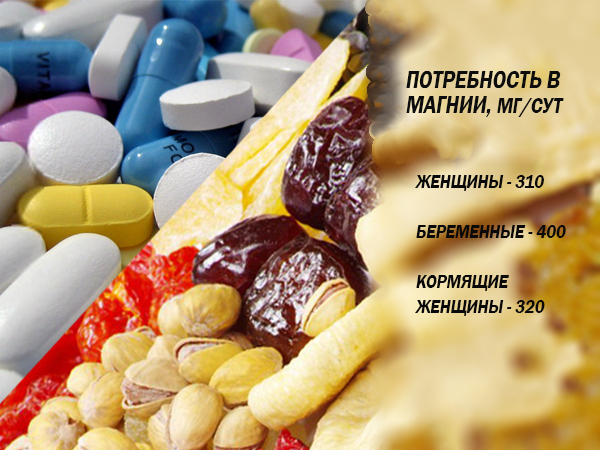
Dzienne zapotrzebowanie na magnez w okresie ciąży i laktacji
Dane dotyczące dobowego zapotrzebowania na magnez u kobiet w ciąży i karmiących piersią w różne źródła są różne. Dietetycy i naukowcy nie osiągnęli jeszcze konsensusu.
Poniżej jest tabela porównawcza rosnące zapotrzebowanie na magnez, biorąc pod uwagę wiek kobiety. Są to liczby, których przestrzega największa liczba specjalistów.
Kiedy magnez jest przepisywany kobiecie w ciąży?
Niedobór magnezu można wykryć za pomocą biochemicznego badania krwi.
- z umiarkowanie ciężkim niedoborem magnezu: 12 - 17 mg / l (0,5 - 0,7 mmol / l);
- z ciężkim niedoborem magnezu: poniżej 12 mg/l (0,5 mmol/l).
Preparaty magnezowe są wskazane w przypadku niedoboru magnezu stwierdzonego w badaniach klinicznych, a także w przypadku pojawienia się opisanych powyżej objawów niedoboru magnezu (drażliwość, płaczliwość, zły sen, zmęczenie, skurcze mięśni itp.).
Dodatkowe spożycie preparatów magnezowych jest bezpośrednio wskazane w hipertoniczności macicy. Stan ten często rozwija się w pierwszym trymestrze ciąży i zwiększa ryzyko poronienia we wczesnych stadiach.Zdarza się, że leczenie przepisuje się na cały okres rodzenia dziecka.
Preparaty magnezowe mogą być przepisywane przez lekarza zarówno na etapie planowania ciąży, jak i podczas ciąży w różnym czasie.
Dobór preparatu magnezowego, określenie jego dawki, postaci dawkowania i czasu trwania leczenia jest dokonywane wyłącznie przez lekarza indywidualnie w każdym przypadku.
Najczęściej lekarz przepisuje magnez kobietom w ciąży w postaci leku Magne B 6. Poniżej znajduje się opis tego leku.
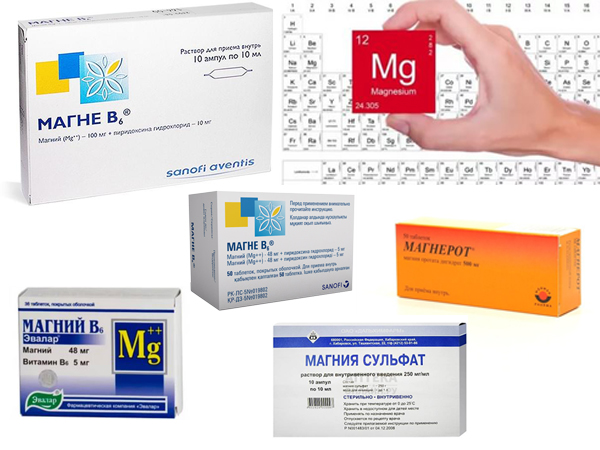
Stosowanie Magne B 6 u kobiet w ciąży
Aktywnymi składnikami Magne B 6 są dwuwodny mleczan magnezu i chlorowodorek pirydoksyny (aktywna forma witaminy B 6). Pirydoksyna poprawia wchłanianie magnezu, wspomaga jego wnikanie do komórek organizmu.
Produkowane są dwie wersje leku: Magne B 6 i Magne B 6 forte. W czasie ciąży wolno przyjmować każdą z tych postaci. Różnica między nimi polega na stężeniu substancji aktywnych.
W Magna B 6 forte ilość substancji aktywnej jest podwojona. Również dzięki zawartości różnych substancji pomocniczych osiągnięto wysoką biodostępność (zdolność do wchłaniania w organizmie). Stopień wchłaniania Magne B 6 forte wynosi około 90%, natomiast biodostępność Magne B6 jest bliska 50%.
Istnieją różne formy uwalniania leku: tabletki powlekane biały kolor, ampułki z roztworem do podawania doustnego i ampułki do wstrzykiwań (roztwór do podawania domięśniowego lub dożylnego). Rozwiązanie jest dostępne w ampułkach z barwionego szkła. W opakowaniu 10 ampułek. Samo rozwiązanie ma brązowy kolor i zapach karmelu.
Przypisany do Magne B 6. 6-8 tabletek w dzień. Z reguły zaleca się przyjmowanie 2 tabletek trzy razy dziennie z posiłkami. Lek w ampułkach do podawania doustnego przyjmuje się 2-4 ampułki / dzień. Ta forma wymaga wstępnego rozcieńczenia leku w 200 mililitrach wody.
Przeciwwskazania i skutki uboczne Magne B 6
Magne B 6 jest przeciwwskazany w:
- Nadwrażliwość na lek i jego składniki.
- Niewydolność nerek.
- Nietolerancja fruktozy, zaburzenia wchłaniania glukozy i galaktozy.
- Fenyloketonuria, gdy metabolizm niektórych aminokwasów jest zaburzony.
- Dzieci poniżej 1 roku życia.
- Karmienie piersią.
Magne B 6 jest ogólnie dobrze tolerowany. Ale instrukcje dotyczące leku obejmują następujące możliwe skutki uboczne:
- ból brzucha;
- zaburzenia stolca w postaci biegunki;
- reakcje alergiczne w postaci pokrzywki, obrzęku Quinckego.
Jeżeli objawy te pojawią się podczas przyjmowania leku, należy niezwłocznie skonsultować się z lekarzem.
Czy długotrwała suplementacja magnezem jest bezpieczna?
Długi kurs w dawkach terapeutycznych przepisanych przez lekarza, z prawidłową czynnością nerek, nie może prowadzić do przedawkowania leku. Wchłanianie magnezu i jego przenikanie do krwi następuje stopniowo. Lek jest wydalany przez nerki. Dlatego zdrowe nerki mogą poradzić sobie z produktami przemiany materii leku i jego nadmiarem.
Preparaty magnezowe wnikają w mleko matki. Dlatego matkom karmiącym nie zaleca się przyjmowania tego leku.
Przepisując suplementy magnezu, należy poinformować lekarza o przyjmowaniu dodatkowych kompleksów multiwitaminowych lub innych leków (wapń, żelazo). Lekarz musi obliczyć wymaganą dawkę magnezu, biorąc pod uwagę zawartość tego pierwiastka śladowego w Twoim kompleksie.
Jest to również ważne, ponieważ magnez i wapń są antagonistami (konkurentami) w organizmie i wzajemnie zakłócają wchłanianie. Ich odbiór należy podzielić według czasu. Nie można również przyjmować jednocześnie magnezu i żelaza, ponieważ zmniejsza to wchłanianie każdego z nich.
Pomimo tego, że preparaty magnezowe są uważane za bezpieczne, nigdy nie należy ich przepisywać samodzielnie. Tylko lekarz może obliczyć dawkę leku i przebieg leczenia, którego potrzebujesz.
Rola w życiu roślin
Zawartość magnezu w roślinach wynosi średnio 0,07% (wagowo). Uczestniczy w wielkim dziele - akumulacji energii słonecznej w procesie fotosyntezy, będącej centralnym atomem w cząsteczce chlorofilu. Chlorofil pochłania energię słoneczną i za jego pomocą przekształca dwutlenek węgla i wodę w złożone substancje organiczne: cukry, skrobię itp. Magnez jest niezbędnym składnikiem rybosomów: przy jego udziale (razem z ATP) aminokwasy są wiązane z tRNA podczas biosyntezy białek . Jony magnezu Mg 2+ „sieciują” cząsteczki białka w kłębuszki, zachowując strukturę cząsteczek białka. Magnez katalizuje syntezę ATP z difosforanów nukleozydów, aktywuje układy enzymatyczne przekształcające kwas jabłkowy w kwas cytrynowy, a kwas szczawiowy w kwas mrówkowy i dwutlenek węgla.
Przy niedoborze magnezu plon uprawianych roślin spada, tworzenie się chloroplastów i chlorofilu zostaje zakłócone: liście (przede wszystkim dolne) stają się „marmurkowate”: bledną między żyłkami i pozostają zielone wzdłuż żył. Tkanki między żyłami mogą przybrać inny kolor - żółty, pomarańczowy, czerwony, fioletowy, następnie obumierają, zaczynając od krawędzi liści: liście zwijają się i stopniowo opadają. U sosny obserwuje się żółknięcie czubków igieł.
Roślinnym wskaźnikiem o wysokiej zawartości magnezu jest kostenet.
Ciało zwierzęcia zawiera około 0,03–0,07% magnezu (w masie), wchodzi w skład kości i zębów, znajduje się w wątrobie, krwi, tkance nerwowej i mózgu oraz bierze udział w metabolizmie białek i węglowodanów. Przy osobie ważącej 70 kg organizm zawiera 19-20 g magnezu. Działa antyseptycznie i rozszerzająco na naczynia krwionośne, obniża ciśnienie krwi i poziom cholesterolu we krwi, nasila procesy hamowania w korze mózgowej, działa uspokajająco (uspokajająco) na układ nerwowy, odgrywa ważną rolę w aktywizacji siły obronne organizm w walce z rakiem. Magnez wzmacnia układ odpornościowy, działa antyarytmicznie, wspomaga regenerację po wysiłku fizycznym.

Przy braku Mg wzrasta podatność na zawał serca. Pokazały to eksperymenty węgierskich naukowców przeprowadzone w XX wieku. na zwierzętach (u zwierząt choroba ta nazywana jest tężyczką ziołową). Niektórym psom podawano karmę bogatą w sole magnezu, innym - ubogą. Pod koniec eksperymentu psy, których dieta była uboga w magnez, „zarobiły” zawał mięśnia sercowego.
Magnez jest wydalany z organizmu wraz z moczem, kałem i potem.
Produkty roślinne: owoce, orzechy (migdały, orzeszki ziemne, orzechy włoskie), warzywa (pomidory, ziemniaki, dynia, fasola, sałata), mięta, cykoria, oliwki, pietruszka, pełnoziarnista pszenica, owies, gryka; chleb żytni, proso, otręby. Produkty pochodzenia zwierzęcego: wątroba, żółtko jaja.

MgSO4- siarczan magnezu, gorzka lub sól Epsom.
MgCO 3– węglan magnezu, magnezyt.
MgO- tlenek magnezu, magnezja palona.
Krzemiany magnezu: talk 3 MgO x 4 SiO 2 x H2O i azbest CaO x 3 MgO x 4 SiO 2.
Chlorofil.
Wiesz to…
Magnez został po raz pierwszy otrzymany w 1808 roku przez angielskiego chemika G. Davy'ego z mokrego tlenku MgO. Nazwa pochodzi od łac. magnezja alba(biała magnezja), według mineralnego hydromagnezytu, który zawiera ten metal i został znaleziony przez starożytnych Greków w pobliżu miasta Magnesia.

Liczba atomów magnezu w organizmie człowieka wynosi 8,7 x 10 23, a w jednej komórce 8,7 x 10 9.
Całkowita ilość magnezu w chlorofilu wszystkich roślin na Ziemi wynosi około 100 miliardów ton.
Dzienne spożycie magnezu z pokarmem w organizmie powinno wynosić 240-720 mg.
Siarczan magnezu MgSO 4 (gorzki lub sól Epsom) jest stosowany w medycynie jako środek przeczyszczający, żółciopędny i przeciwbólowy.
Jony magnezu nie tylko nadają wodzie morskiej słony smak, ale także sprawiają, że nie nadaje się ona do picia, powodując ostrą biegunkę i wymioty.
Istnieje kilka rodzajów chlorofilu (chlorofil a, b, c, d), które różnią się budową i widmami absorpcji. Rośliny wyższe i glony zawierają chlorofil jako główny pigment. a, a jako dodatek - chlorofil b, okrzemki i brunatnice - tylko chlorofil C i krasnorosty – chlorofil D.
Żelazo

Rola w życiu roślin i mikroorganizmów
Wraz z jego niedoborem następuje spowolnienie powstawania chlorofilu. Być może pojawienie się chlorozy (żółty kolor) na pierwszym miejscu młodych liści, ich utrata koloru. Przy długotrwałym niedoborze żelaza w roślinach zielnych tkanka wzdłuż krawędzi blaszki liściowej obumiera, pędy obumierają na drzewach, a ogólna produktywność i odporność roślin na choroby spada.
Piołun i niektóre inne rośliny są wskaźnikami wysokiej zawartości żelaza w glebie. W tym samym czasie liście piołunu stają się jasnożółte, a kwiaty niektórych roślin, takich jak hortensje, nabierają niezwykłego niebieskiego koloru.
W naturze występują tak zwane bakterie żelazne. W procesie chemosyntezy utleniają żelazo żelazawe do żelaza żelazowego, które osadza się na powierzchni komórki. Utworzony wodorotlenek żelaza (III) wytrąca się i tworzy tak zwaną rudę bagienną:
4FeCO 3 + O 2 + 6H 2 O ––> 4Fe(OH) 3 + 4CO 2 + energia
Bakterie chemosyntetyczne, które utleniają związki żelaza i manganu, zostały odkryte przez Academician S.N. Winogradski. Są niezwykle rozpowszechnione zarówno w wodach słodkich, jak i morskich. Dzięki ich żywotnej aktywności na dnie bagien i mórz powstają ogromne pokłady rud żelaza i manganu. W I. Vernadsky, twórca biogeochemii, mówił o złożach takich rud w wyniku żywotnej aktywności bakterii w starożytnych okresach geologicznych.
Rola w życiu zwierząt i ludzi
Ciało zwierzęcia zawiera około 0,01% żelaza (masowo). Żelazo jest niezbędne w procesach hematopoezy i metabolizmu wewnątrzkomórkowego. Około 55% żelaza wchodzi w skład hemoglobiny erytrocytów, około 24% bierze udział w tworzeniu substancji barwiącej mięśni (mioglobiny), około 21% odkłada się „w rezerwie” w wątrobie i śledzionie.

To żelazo decyduje o kolorze krwi, a także o jej zdolności do wiązania i uwalniania tlenu. Czerwone krwinki przenoszą tlen z płuc w całym ciele i usuwają dwutlenek węgla. Tlen jest silnym utleniaczem, ale hemoglobina dzięki zawartemu w nim żelazu jest w stanie przenosić tlen. Organizm ludzki zawiera enzymy zawierające żelazo. Istnieje również kompleks białek ferrytyny, z którego powstają wszystkie inne substancje zawierające żelazo niezbędne dla organizmu. Jony żelaza w organizmie są przenoszone za pomocą złożonej transferyny białkowej (znajdującej się w osoczu krwi, mleku, białku jaja). Żelazo odgrywa ważną rolę w procesach uwalniania energii, w reakcjach enzymatycznych, w zapewnianiu funkcji immunologicznych, w metabolizmie cholesterolu.
Przy osobie ważącej 70 kg ciało zawiera 4,2–5 g żelaza. Dzienne zapotrzebowanie dorosłej zdrowej osoby na żelazo wynosi 10-20 mg i jest uzupełniane normalną zbilansowaną dietą.
Wraz ze spadkiem ilości żelaza we krwi pojawia się anemia. Najczęstszą jest niedokrwistość z niedoboru żelaza lub, jak to się od dawna nazywa, niedokrwistość.

Żelazo jest wydalane z organizmu wraz z moczem, kałem i potem.
Główne źródła wejścia do organizmu
Warzywa zielone: cebula, czubki młodej rzepy, rzodkiewka, musztarda, marchew, rzeżucha, szczaw, zielony groszek, pomidory (tylko na surowo), kapusta, czosnek, soczewica, chrzan, ogórki. Owoce i jagody: jabłka, granat, maliny, truskawki, wiśnie, gruszki, winogrona, arbuzy, wszelkie suszone owoce. Produkty zwierzęce: wątroba, nerki, żółtko jaja.
Najpopularniejsze połączenia
Hemoglobina.
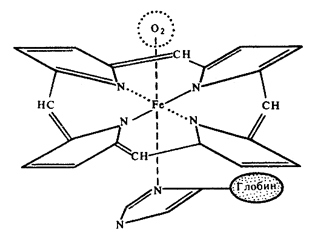
Schemat wiązania hem-globina w cząsteczce hemoglobiny
Wiesz to…
O znajomości starożytnego człowieka z żelazem o kosmicznym pochodzeniu świadczy fakt, że mieszkańcy Grenlandii, którzy nie mieli pojęcia o rudzie żelaza, mieli wyroby z żelaza. Wiele meteorytów składa się z rodzimego żelaza z domieszką niklu do 5,5%. Alchemicy oznaczali żelazo w postaci włóczni i tarczy - charakterystyczne atrybuty boga wojny Marsa. Stąd jego nazwa od łac. ferro- miecz.
Liczba atomów żelaza w ludzkim ciele wynosi 4,5 x 10 22, a w jednej komórce 4,5 x 10 8.
100 ml ludzkiej krwi zawiera 13-16 g hemoglobiny.
„Złożenie” cząsteczki hemoglobiny w ludzkim ciele zajmuje około 90 sekund, a na sekundę powstaje 650 x 1012 cząsteczek hemoglobiny.
Wiele żywych obiektów charakteryzuje się zjawiskiem biomagnetyzmu. Ich orientacja w polu magnetycznym Ziemi odbywa się za pomocą tlenku żelaza, który znajduje się w specjalnych formacjach - magnetosomach, utworzonych w postaci łańcuchów 10–25 kryształów o łącznej długości około 50 nm.
Sole żelaza żelazawego i żelazowego są stosowane w celu wyrównania niedoboru żelaza w leczeniu anemii.
Stwierdzono korelację między zwiększoną zawartością żelaza w organizmie a wczesny rozwój miażdżyca, choroba niedokrwienna, nowotwory.

Witriol żelazowy FeSO 4 x 7H 2 O (krystaliczny hydrat żelaza(II)) służy do zwalczania szkodników roślin oraz do przygotowania farb mineralnych. Chlorek żelaza (III) FeCl 3 jest stosowany jako zaprawa do farbowania tkanin.
Cynk

Rola w życiu roślin, grzybów
Cynk jest ważnym mikroelementem, jego zawartość w roślinach wynosi średnio 0,003% (wagowo). Aktywuje 30 układów enzymatycznych w komórce. Grzyby (zwłaszcza trujące), porosty, drzewa iglaste są bogate w cynk. W roślinach cynk, obok udziału w oddychaniu, metabolizmie białek i jąder, reguluje wzrost, wpływa na tworzenie aminokwasu tryptofanu oraz zwiększa zawartość giberelin. Cynk jest niezbędny do rozwoju jaja i płodu. Zwiększa odporność roślin na suszę, ciepło i zimno.
Jej niedobór prowadzi do zaburzeń podziału komórek (plamka liści u owoców cytrusowych), na roślinach tworzą się wąskie liście skręcone w spiralę. Tkanka między żyłami odbarwia się i wyróżniają się wyraźną zieloną siateczką.
Nadmiar cynku jest szkodliwy dla roślin, ponieważ. może powodować deformację narządów: w maku kwiaty stają się podwójne, a w jarutka płatki stają się bardzo duże. U innych roślin możliwa jest chloroza liści, rozprzestrzeniająca się od wierzchołka do podstawy liścia. Rośliny-indykatorami zwiększonej zawartości cynku w glebie to fiołek trójbarwny, skrzyp, bratek.
Rola w życiu zwierząt i ludzi
Zawartość cynku w ciele zwierzęcia wynosi około 0,01% (wagowo). Niektóre bezkręgowce morskie, takie jak ostrygi, zawierają 0,4% cynku (wagowo). Sporo cynku w jadzie węża (dla ochrony przed skutkami własnej trucizny). U zwierząt Zn oprócz udziału w oddychaniu i metabolizmie nukleinowym zwiększa aktywność gonad, wpływa na kształtowanie się szkieletu płodu. Przy braku cynku zmniejsza się zawartość RNA i zmniejsza się synteza białek w mózgu, spowalnia rozwój mózgu.
Przy osobie ważącej 70 kg organizm zawiera do 3 g cynku. Wchodzi w skład najważniejszych enzymów: anhydrazy węglanowej (przyspiesza uwalnianie dwutlenku węgla w płucach), różnych dehydrogenaz, fosfataz (związanych z oddychaniem i innymi procesami fizjologicznymi), proteaz i peptydaz biorących udział w metabolizmie białek, enzymów metabolizmu nukleinowego ( polimerazy RNA i DNA). Cynk gra zasadnicza rola w syntezie cząsteczek mRNA na odpowiednich odcinkach DNA (transkrypcja), w stabilizacji struktur rybosomów i biopolimerów (RNA, DNA, niektóre białka). Cynk jest istotną częścią enzymów krwi. Jest niezbędny do utrzymania prawidłowego wzrostu skóry, włosów i paznokci oraz gojenia się ran, ponieważ bierze udział w syntezie białek. Cynk jest częścią insuliny, hormonu trzustkowego, który reguluje poziom cukru we krwi, oraz hormonu grasicy. Cynk odgrywa ważną rolę w przetwarzaniu alkoholu przez organizm, dlatego jego brak może zwiększać predyspozycje do alkoholizmu (szczególnie u dzieci i młodzieży). Do lepszego wchłaniania cynku przez organizm potrzebne są witaminy A i B6.

Niedobór Zn prowadzi do karłowatości, opóźnionego rozwoju płciowego.
Nadmiar cynku ma negatywny wpływ na pracę serca i krwi. To nie przypadek, że zawartość cynku w środkach spożywczych jest regulowana zgodnie z MPC: żywność dla dzieci i dietetyczna - 5,0 mg/kg; olej roślinny - 10,0 mg/kg; białko sojowe - 60,0 mg / kg.
W komórkach i poszczególnych narządach podczas ich złośliwej transformacji wzrasta zawartość niektórych jonów metali. Stężenie cynku wzrasta kilkakrotnie. Przyczyny nie są jeszcze znane, ale spekuluje się, że może to służyć: wczesna diagnoza nowotwór.
Cynk jest wydalany z organizmu wraz z moczem, kałem, potem.

Główne źródła wejścia do organizmu
Produkty warzywne: warzywa, kukurydza, orzechy, wyroby piekarnicze. Grzyby. Produkty zwierzęce: wołowina, wątroba, mięso, mleko; owoce morza (ostrygi, małże, śledź).
Najpopularniejsze połączenia
ZnS- siarczek cynku, mieszanka cynku.
ZnSO4 x 7H2O- wodorosiarczan cynku, witriol cynku.
ZnCl2- chlorek cynku.
Wiesz to...
Uważa się, że rudy cynku znane są ludziom od czasów starożytnych. W II wieku p.n.e. Grecy wiedzieli już, jak wytapiać mosiądz – stop cynku i miedzi. w Indiach w XII wieku. istniała produkcja metalicznego cynku, ale w Europie pojawiła się znacznie później. Saksoński metalurg I. Genkel opisał cynk jako metal, aw 1746 r. niemiecki chemik A. Marggraf opracował metody otrzymywania cynku z minerałów kalaminy i sfalerytu ZnS (mieszanka cynkowa). Od niego pochodzi nazwa. cynk- biały metal.
Liczba atomów cynku w ludzkim ciele wynosi 2,2 x 10 22, aw jednej komórce - 2,2 x 108.
Dzienne spożycie cynku w organizmie wraz z pożywieniem wynosi 13 mg.
Istnieje ponad 200 enzymów zawierających cynk.
Zawiesina, która zawiera insulinę, protaminę i chlorek cynku, jest skutecznym środkiem przeciwcukrzycowym, działającym lepiej niż czysta insulina.
We współczesnej medycynie związki cynku znajdują zastosowanie w leczeniu różnych niedoborów odporności, niepłodności, chorób skóry, włosów, paznokci i wątroby. W postaci roztworu chlorek cynku ZnCl 2 jest stosowany jako środek kauteryzujący, maść cynkowa ZnO jako środek wysuszający, ściągający i dezynfekujący w chorobach skóry, w skład kropli wchodzi witriol cynku ZnSO 4 x 7H 2 O.
Związki cynku przyczyniają się do zapobiegania przeziębieniom u dzieci, poprawiają apetyt, wzrost, rozwój, zwiększają koncentrację.
Ciąg dalszy nastąpi
Wszystko zaczęło się od fotosyntezy. Co ciekawe, znaczenie magnezu dla naszego organizmu i konsekwencje jego niedoboru zaczęto oceniać w tym samym czasie, w którym odkryto tajemnice fotosyntezy roślin – zaledwie kilkadziesiąt lat temu.
Proces ciągłego tworzenia się materii organicznej rozpoczął się miliardy lat temu, kiedy na Ziemi pojawiły się pigmenty powodujące reakcje chemiczne poprzez pochłanianie światła słonecznego. Decydującą rolę odegrały w tym „światłoczułe” substancje z grupy utworzonej ze związków prostych – oraz gliceryny. Jednak dopiero wraz z pojawieniem się pochodnej magnezowej porfiryny w postaci chlorofilu nastąpiło to Historia naturalna wyższe formy życia organicznego. Chlorofil ma zdolność przeprowadzania nieodwracalnej reakcji fotochemicznej, której energia kumulowana jest w stabilnych związkach biochemicznych.
Proces fotosyntezy ukształtował się prawdopodobnie pod koniec okresu prekambryjskiego (około 1000 mln lat temu). Struktura chlorofilu jest bardzo zbliżona do struktury hemu, głównego składnika barwnika krwi. Różnica polega na tym, że chlorofil zawiera magnez (jon magnezu) i hem, hemoglobinę - (jon żelaza). To odkrycie profesora Uniwersytetu Jagiellońskiego Leona Marklevsky'ego potwierdziło związek między ewolucją flory i fauny.
Można powiedzieć, że to samo dzieje się z człowiekiem, chociaż… wszystko jest znacznie bardziej skomplikowane. Osoba nie może być zdrowa, jeśli w jedzeniu nie ma wystarczającej ilości magnezu. Do takiego wniosku doszli uczestnicy I Kongresu Chorób Wywołanych Niedoborem Magnezu. Kongres odbył się w maju 1971 w Vittel. Jon magnezu odgrywa szczególną rolę w prawie wszystkich procesach zachodzących w organizmie. Czyli w procesach odpornościowych działa antystresowo, antytoksycznie, antyalergicznie, antyanafilaktycznie (rodzaj wrażliwości), przeciwzapalnie, chroniąc przed promieniowaniem jonizującym, regulując temperaturę, stymulując i biorąc udział w tworzeniu przeciwciał. Magnez działa relaksująco i zmniejsza wrażliwość organizmu. To właśnie wtedy, na kongresie w Vittel, profesor Dürlach powiedział: „Znakiem współczesnego cywilizowanego świata jest stale zmniejszający się poziom jonów magnezu”.
Wydaje się, że choroby cywilizacyjne są w dużej mierze spowodowane niedoborem magnezu w organizmie człowieka. Warto więc przyjrzeć się bliżej magnezowi.
Magnez pozyskujemy z gleby – poprzez pokarmy roślinne oraz pokarmy pochodzące od roślinożernych zwierząt. Tak więc do naszego organizmu dostaje się tyle samo magnezu, ile jest w glebie.
Tymczasem w glebie jest mało magnezu. Niedobór magnezu występuje na 40% gruntów Polski, przeciętna zawartość na 34%, a wystarczająca lub wysoka na mniej niż 26%. Nawozy sztuczne albo w ogóle nie wzbogacają gleby w magnez, albo otrzymują go za mało. Na przykład w latach 1971-1975. Średnia ilość dodawanego magnezu na ziemie polskie wynosiła 10-12 kg tlenku magnezu (MgO) na 1 ha użytków rolnych. Dużo czy mało? Pszenica z plonem 40 q/ha powinna otrzymać z gleby ok. 17 kg z 1 ha MgO, a buraki cukrowe z plonem zaledwie 350 q/ha - ok. 66 kg.
Oczywiście potrzebna ilość nawozu magnezowego zależy od zawartości magnezu w glebie i rodzaju uprawianej rośliny. Zwykle jest to od 130 do 260 kg/ha. Z tej ilości kizerytu (nawozu magnezowego) przechodzi do gleby 30-60 kg tlenku magnezu i dodatkowo 15-31 kg tlenku potasu. Obornik zawiera 0,18% magnezu, co oznacza, że jeśli zastosujemy 300 kg obornika na 1 ha, otrzymamy około 54 kg Mg. To zdecydowanie za mało.
Chlorofil zawiera 2,7% magnezu. Jony magnezu regulują stopień nawodnienia komórek. Przy braku magnezu w roślinach proces parowania wody jest ograniczony, a przy nadmiarze roślina intensywnie pobiera wodę, przez co gleba w obrębie systemu korzeniowego przesycha.
Dla zainteresowanych przygotowaliśmy stolik.
Elementy mineralne.doc
Minerały1. Rola pierwiastków mineralnych w organizmie człowieka 1
2. Makroelementy, ich charakterystyka
3. Pierwiastki śladowe, ich charakterystyka
4. Wpływ obróbki technologicznej
O składzie mineralnym produktów spożywczych
5. Metody oznaczania substancji mineralnych
1. Rola pierwiastków mineralnych w organizmie człowieka
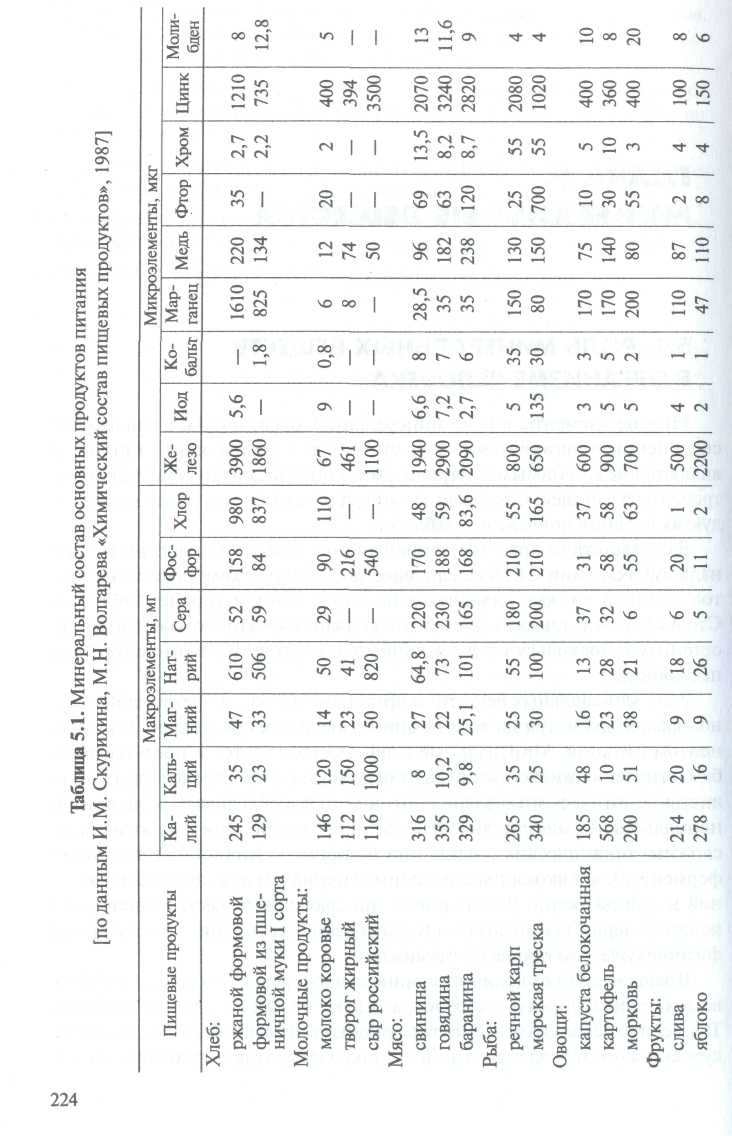
Wiele pierwiastków w postaci soli mineralnych, jonów, związków kompleksowych i materia organiczna są częścią żywej materii i są niezbędnymi składnikami odżywczymi, które należy codziennie spożywać z pożywieniem. Zawartość składników mineralnych w głównych produktach spożywczych podana jest w tabeli. 5.1.
Zgodnie z zaleceniami Rady Dietetycznej Akademia Narodowa W USA dzienne spożycie pierwiastków chemicznych z pożywieniem powinno być na pewnym poziomie (tab. 5.2). Ta sama liczba pierwiastków chemicznych musi być codziennie wydalana z organizmu, ponieważ ich zawartość w nim jest stosunkowo stała.
Rola minerałów w organizmie człowieka jest niezwykle zróżnicowana, mimo że nie są one niezbędnym składnikiem pożywienia. Substancje mineralne zawarte w protoplazmie i płynach biologicznych odgrywają główną rolę w zapewnieniu stałości ciśnienia osmotycznego, które jest niezbędnym warunkiem prawidłowego funkcjonowania komórek i tkanek. Wchodzą w skład złożonych związków organicznych (np. hemoglobiny, hormonów, enzymów), są tworzywem sztucznym do budowy tkanki kostnej i zębowej. W postaci jonów substancje mineralne biorą udział w przekazywaniu impulsów nerwowych, zapewniają krzepnięcie krwi i inne procesy fizjologiczne organizmu.
 |
W zależności od ilości minerałów w organizmie człowieka i produktach spożywczych dzieli się je na: makro- I pierwiastki śladowe. Jeśli więc ułamek masowy pierwiastka w organizmie przekracza 10 -2%, należy go uznać za makroelement. Proporcja pierwiastków śladowych w organizmie wynosi 10 -3 -10 -5%. Jeśli zawartość pierwiastka jest poniżej 10 -5%, uważa się go za ultramikroelement. Makroelementy obejmują potas, sód, wapń, magnez, fosfor, chlor i siarkę. Są one zawarte w ilościach mierzonych w setkach i dziesiątkach miligramów na 100 g tkanki lub pożywienia. Pierwiastki śladowe wchodzą w skład tkanek organizmu w stężeniach wyrażonych w dziesiątych, setnych i tysięcznych miligrama i są niezbędne do jego normalnego funkcjonowania. Pierwiastki śladowe są warunkowo podzielone na dwie grupy: absolutnie lub witalną (kobalt, żelazo, miedź, cynk, mangan, jod, brom, fluor) i tzw. prawdopodobnie niezbędne (glin, stront, molibden, selen, nikiel, wanad i kilka innych ). Pierwiastki śladowe nazywane są niezbędnymi, jeśli ich brak lub niedobór powoduje zakłócenie normalnego funkcjonowania organizmu.
Rozmieszczenie pierwiastków śladowych w organizmie zależy od ich właściwości chemiczne i bardzo urozmaicone. Na przykład żelazo jest integralną częścią hemoglobiny, mioglobiny i innych barwników oddechowych, czyli substancji zaangażowanych w wchłanianie i transport tlenu do wszystkich tkanek organizmu; atomy miedzi są zawarte w aktywnym centrum wielu enzymów itp.
Działanie mikroelementów może być również pośrednie – poprzez wpływ na intensywność lub charakter metabolizmu. Tak więc niektóre mikroelementy (np. mangan, cynk, jod) wpływają na wzrost, a ich niewystarczające spożycie z pokarmem hamuje normalne rozwój fizyczny dziecko. Inne pierwiastki śladowe (np. molibden, miedź, mangan) biorą udział w czynnościach rozrodczych, a ich niedobór w organizmie negatywnie wpływa na tę stronę życia człowieka.
Do najbardziej ubogich minerałów w diecie nowoczesny mężczyzna obejmują wapń i żelazo, nadmiar - sód i fosfor.
Brak lub nadmiar w diecie jakichkolwiek substancji mineralnych powoduje naruszenie metabolizmu białek, tłuszczów, węglowodanów, witamin, co prowadzi do rozwoju wielu chorób. Poniżej przedstawiamy charakterystyczne (typowe) objawy niedoboru różnych pierwiastków chemicznych w organizmie człowieka: Najczęstszą konsekwencją niedopasowania ilości wapnia i fosforu w diecie jest próchnica zębów, przerzedzenie kości. Przy braku fluoru w wodzie pitnej szkliwo zębów ulega zniszczeniu, niedobór jodu w pożywieniu i wodzie prowadzi do chorób tarczycy. Tak więc minerały są bardzo ważne w eliminowaniu i zapobieganiu wielu chorobom.


Wymieniamy przyczyny zaburzeń metabolicznych substancji mineralnych, które mogą wystąpić nawet przy ich wystarczającej ilości w pożywieniu:
A) niezrównoważone odżywianie (niewystarczająca lub nadmierna ilość białek, tłuszczów, węglowodanów, witamin itp.);
B) stosowanie metod kulinarnego przetwarzania żywności, powodujących utratę składników mineralnych np. podczas rozmrażania (w gorąca woda) mięso, ryby lub przy usuwaniu wywarów z warzyw i owoców, gdzie przechodzą sole rozpuszczalne;
C) brak terminowej korekty składu diety, gdy zmienia się zapotrzebowanie organizmu na składniki mineralne związane z przyczynami fizjologicznymi. Na przykład osoby pracujące w warunkach podniesiona temperaturaśrodowisko zewnętrzne wzrasta zapotrzebowanie na potas, sód, chlor i inne minerały, ponieważ większość z nich jest wydalana z organizmu wraz z potem;
D) naruszenie procesu wchłaniania minerałów w przewodzie pokarmowym lub zwiększona utrata płynów (na przykład utrata krwi).
^
2. Makroelementy, ich charakterystyka
Wapń. Jest głównym składnikiem strukturalnym kości i zębów; wchodzi w skład jąder komórkowych, płynów komórkowych i tkankowych, jest niezbędny do krzepnięcia krwi. Wapń tworzy związki z białkami, fosfolipidami, kwasami organicznymi; uczestniczy w regulacji przepuszczalności błon komórkowych, w przekazywaniu impulsów nerwowych, w molekularnym mechanizmie skurczów mięśni, kontroluje aktywność szeregu enzymów. Więc wapń pełni nie tylko funkcje plastyczne, ale także wpływa na wiele procesów biochemicznych i fizjologicznych w organizmie.
Wapń jest pierwiastkiem ciężkostrawnym. Związki wapnia dostające się do organizmu człowieka wraz z pożywieniem są praktycznie nierozpuszczalne w wodzie. Alkaliczne środowisko jelita cienkiego sprzyja powstawaniu niestrawnych związków wapnia, a jedynie działanie kwasów żółciowych zapewnia jego wchłanianie.
Przyswajanie wapnia przez tkanki zależy nie tylko od jego zawartości w pożywieniu, ale także od jego stosunku do innych składników pożywienia, a przede wszystkim do tłuszczów, magnezu, fosforu i białek. Przy nadmiarze tłuszczu dochodzi do konkurencji o kwasy żółciowe, a znaczna część wapnia jest wydalana z organizmu przez jelito grube. Na wchłanianie wapnia niekorzystnie wpływa nadmiar magnezu; zalecany stosunek tych pierwiastków to 1:0,5. Jeśli ilość fosforu przekracza poziom wapnia w pożywieniu ponad 2 razy, powstają rozpuszczalne sole, które są ekstrahowane przez krew z tkanki kostnej. Wapń przedostaje się do ścian naczyń krwionośnych, co powoduje ich kruchość, a także do tkanek nerek, co może przyczynić się do powstawania kamieni nerkowych. Dla dorosłych zalecana proporcja wapnia i fosforu w pożywieniu wynosi 1:1,5. Trudność w utrzymaniu tego wskaźnika wynika z faktu, że najczęściej spożywane pokarmy są znacznie bogatsze w fosfor niż w wapń. Zawarte w wielu produktach roślinnych fityna i kwas szczawiowy mają negatywny wpływ na przyswajanie wapnia. Związki te tworzą z wapniem nierozpuszczalne sole.
Dzienne zapotrzebowanie na wapń u osoby dorosłej wynosi 800 mg, a u dzieci i młodzieży 1000 mg lub więcej.
Przy niewystarczającym spożyciu wapnia lub z naruszeniem jego wchłaniania w organizmie (przy braku witaminy D) rozwija się stan niedoboru wapnia. Następuje zwiększone wydalanie go z kości i zębów. U dorosłych rozwija się osteoporoza - demineralizacja tkanki kostnej, u dzieci zaburzona jest budowa szkieletu, rozwija się krzywica.
Najlepszymi źródłami wapnia są mleko i przetwory mleczne, różne sery i twarogi (100-1000 mg/100 g produktu), szczypiorek, pietruszka, fasola. Znacznie mniej wapnia znajduje się w jajach, mięsie, rybach, warzywach, owocach, jagodach (20-40 mg/100 g produktu).
Magnez. Ten pierwiastek jest niezbędny do aktywności wielu kluczowych enzymów. dla metabolizmu organizmu. Magnez bierze udział w utrzymaniu prawidłowego funkcjonowania układu nerwowego i mięśnia sercowego; ma działanie rozszerzające naczynia krwionośne; stymuluje wydzielanie żółci; podnosi aktywność silnika jelit, co pomaga w usuwaniu toksyn z organizmu (w tym cholesterolu).
Wchłanianie magnezu jest utrudnione przez obecność fityny oraz nadmiaru tłuszczu i wapnia w pożywieniu. Dzienne zapotrzebowanie na magnez nie jest dokładnie określone; uważa się jednak, że dawka 200-300 mg/dobę zapobiega wystąpieniu objawów niedoboru (przyjmuje się, że wchłania się około 30% magnezu).
Przy braku magnezu wchłanianie pokarmu jest zaburzone, wzrost jest opóźniony, wapń odkłada się w ścianach naczyń krwionośnych i rozwija się szereg innych zjawisk patologicznych. U ludzi brak jonów magnezu, ze względu na charakter odżywiania, jest niezwykle mało prawdopodobny. Jednak przy biegunce mogą wystąpić duże straty tego pierwiastka; ich konsekwencje są odczuwalne w przypadku wprowadzenia do organizmu płynów niezawierających magnezu. Gdy stężenie magnezu w surowicy spada do około 0,1 mmol/l może wystąpić syndrom przypominający delirium tremens: osoba w stanie półśpiączki, drżenie mięśni, skurcze mięśni nadgarstka i stopy, zwiększona pobudliwość nerwowo-mięśniowa w odpowiedzi na dźwięk, mechaniczna i bodźce wizualne. Wprowadzenie magnezu powoduje szybką poprawę kondycji.
Magnez jest bogaty głównie w pokarmy roślinne. Duża jego ilość zawiera otręby pszenne, różne zboża (40 - 200 mg/100 g produktu), rośliny strączkowe, morele, morele suszone, suszone śliwki. W produktach mlecznych, mięsie, rybach, makaronach, większości warzyw i owoców jest mało magnezu (20 - 40 mg/100 g).
Potas. Około 90% potasu znajduje się w komórkach. Wraz z innymi solami zapewnia ciśnienie osmotyczne; uczestniczy w przekazywaniu impulsów nerwowych; regulacja metabolizmu wody i soli; wspomaga usuwanie wody, a co za tym idzie toksyn z organizmu; utrzymuje równowagę kwasowo-zasadową środowiska wewnętrznego organizmu; uczestniczy w regulacji czynności serca i innych narządów; niezbędne do funkcjonowania wielu enzymów.
Potas dobrze wchłania się z jelit, a jego nadmiar jest szybko usuwany z organizmu wraz z moczem. Dzienne zapotrzebowanie na potas u osoby dorosłej wynosi 2000-4000 mg. Zwiększa się przy obfitej potliwości, przy stosowaniu leków moczopędnych, chorobach serca i wątroby. Potas nie jest składnikiem niedoborowym w diecie, a przy zróżnicowanej diecie niedobór potasu nie występuje. Niedobór potasu w organizmie pojawia się przy upośledzeniu funkcji układu nerwowo-mięśniowego i sercowo-naczyniowego, senności, obniżeniu ciśnienia krwi, zaburzeniach rytmu serca. W takich przypadkach zalecana jest dieta potasowa.
Większość potasu pochodzi z pokarmów roślinnych. Jej bogatym źródłem są morele, suszone śliwki, rodzynki, szpinak, wodorosty, fasola, groch, ziemniaki, inne warzywa i owoce (100 - 600 mg/100 g produktu). Mniej potasu znajduje się w śmietanie, ryżu, pieczywie z mąki premium (100 - 200 mg/100 g).
Sód. Sód znajduje się we wszystkich tkankach i płynach ustrojowych. Zajmuje się utrzymywaniem ciśnienia osmotycznego w płynach tkankowych i krwi; w przekazywaniu impulsów nerwowych; regulacja równowagi kwasowo-zasadowej, metabolizmu wodno-solnego; zwiększa aktywność enzymów trawiennych.
Metabolizm sodu został szeroko zbadany ze względu na jego właściwości fizjologiczne i znaczenie dla organizmu. Ten składnik odżywczy jest łatwo wchłaniany z jelit. Jony sodu powodują obrzęk koloidów tkankowych, co powoduje zatrzymywanie wody w organizmie i przeciwdziała jej uwalnianiu. Całkowita ilość sodu w płynie pozakomórkowym określa zatem objętość tych płynów. Wzrost stężenia sodu w osoczu prowadzi do uczucia pragnienia. W gorącym klimacie i podczas ciężkiej pracy fizycznej wraz z potem dochodzi do znacznego ubytku sodu i konieczne jest wprowadzenie soli do organizmu w celu uzupełnienia utraconej ilości.
Zasadniczo jony sodu dostają się do organizmu kosztem soli kuchennej - NaCl. Przy nadmiernym spożyciu chlorku sodu pogarsza się usuwanie rozpuszczalnych w wodzie końcowych produktów przemiany materii przez nerki, skórę i inne narządy wydalnicze. Zatrzymywanie wody w organizmie komplikuje pracę układu sercowo-naczyniowego, podnosi ciśnienie krwi. W związku z tym spożycie soli w odpowiednich chorobach w diecie jest ograniczone. Jednak podczas pracy w gorących sklepach lub gorącym klimacie ilość sodu (w postaci soli kuchennej) wprowadzanego z zewnątrz jest zwiększana, aby zrekompensować jego utratę wraz z potem i zmniejszyć pocenie się, które obciąża pracę serca.
Sód jest naturalnie obecny we wszystkich produktach spożywczych. Sposób otrzymywania produktów spożywczych w dużej mierze determinuje ostateczną zawartość w nim sodu. Na przykład mrożony zielony groszek zawiera znacznie więcej sodu niż świeży. Świeże warzywa i owoce zawierają mniej niż 10 mg/kg do 1 g/kg, w przeciwieństwie do zbóż i serów, które mogą zawierać sód w ilości 10-20 g/kg.
Oszacowanie średniego dziennego spożycia sodu z pożywienia jest trudne, ponieważ stężenie sodu w pożywieniu jest bardzo zróżnicowane, a ponadto ludzie są przyzwyczajeni do dodawania soli do żywności. Osoba dorosła spożywa do 15 g soli kuchennej dziennie i tyle samo wydala z organizmu. Ta ilość jest znacznie wyższa niż fizjologicznie konieczna i zależy przede wszystkim od smaku chlorku sodu, nawyku spożywania słonych potraw. Zawartość soli kuchennej w żywności dla ludzi można zmniejszyć do 5 g dziennie bez szkody dla zdrowia. Na uwalnianie chlorku sodu z organizmu, a co za tym idzie na jego zapotrzebowanie, wpływa ilość soli potasowych otrzymywanych przez organizm. Pokarmy roślinne, zwłaszcza ziemniaki, są bogate w potas i zwiększają wydalanie chlorku sodu z moczem, a co za tym idzie, zwiększają jego zapotrzebowanie.
Fosfor. Fosfor znajduje się we wszystkich tkankach ciała, zwłaszcza w mięśniach i mózgu. Ten pierwiastek bierze udział we wszystkich procesach życiowych organizmu. : synteza i rozkład substancji w komórkach; regulacja metabolizmu; wchodzi w skład kwasów nukleinowych i szeregu enzymów; potrzebne do powstania ATP.
Fosfor występuje w tkankach organizmu i produktach spożywczych w postaci kwasu fosforowego i jego związków organicznych (fosforanów). Jego główna masa znajduje się w tkance kostnej w postaci fosforanu wapnia, reszta fosforu wchodzi w skład tkanek miękkich i płynów. W mięśniach zachodzi najintensywniejsza wymiana związków fosforu. Kwas fosforowy bierze udział w budowie cząsteczek wielu enzymów, kwasów nukleinowych itp.
Przy długotrwałym niedoborze fosforu w diecie organizm wykorzystuje własny fosfor z tkanki kostnej. Prowadzi to do demineralizacji kości i naruszenia ich struktury - rozrzedzenia. Kiedy organizm jest wyczerpany fosforem, zmniejsza się sprawność psychiczna i fizyczna, obserwuje się utratę apetytu, apatię.
Dzienne zapotrzebowanie na fosfor dla dorosłych wynosi 1200 mg. Zwiększa się wraz z dużym stresem fizycznym lub psychicznym, z niektórymi chorobami.
Duża ilość fosforu znajduje się w produktach pochodzenia zwierzęcego, zwłaszcza w wątrobie, kawiorze, a także w zbożach i roślinach strączkowych. Jego zawartość w tych produktach waha się od 100 do 500 mg na 100 g produktu. Bogatym źródłem fosforu są zboża (płatki owsiane, kasza pęczak), zawierają 300-350 mg fosforu/100 g. Jednak związki fosforu są gorzej przyswajane z produktów roślinnych niż przy spożywaniu pokarmów pochodzenia zwierzęcego.
Siarka. O znaczeniu tego pierwiastka w żywieniu decyduje przede wszystkim fakt, że wchodzi on w skład białek w postaci aminokwasów zawierających siarkę. (metionina i cystyna), a także jest integralną częścią niektórych hormonów i witamin.
Jako składnik aminokwasów zawierających siarkę, siarka bierze udział w procesach metabolizmu białek, a jej zapotrzebowanie dramatycznie wzrasta podczas ciąży i wzrostu ciała, czemu towarzyszy aktywne włączanie białek do powstałych tkanek, a także podczas stanów zapalnych procesy. Aminokwasy zawierające siarkę, szczególnie w połączeniu z witaminami C i E, mają wyraźne działanie przeciwutleniające. Wraz z cynkiem i krzemem siarka decyduje o stanie funkcjonalnym włosów i skóry.
Chlor. Pierwiastek ten bierze udział w tworzeniu soku żołądkowego, tworzeniu osocza, aktywuje szereg enzymów. Ten składnik odżywczy jest łatwo wchłaniany z jelit do krwi. Interesująca jest zdolność chloru do odkładania się w skórze, zatrzymywania się w organizmie przy nadmiernym spożyciu oraz wydalania z potem w znacznych ilościach. Wydalanie chloru z organizmu następuje głównie z moczem (90%) i potem.
Naruszenia w wymianie chloru prowadzą do rozwoju obrzęku, niewystarczającego wydzielania soku żołądkowego itp. Gwałtowny spadek zawartości chloru w organizmie może prowadzić do poważnego stanu, a nawet śmierci. Wzrost jego stężenia we krwi następuje z odwodnieniem organizmu, a także z naruszeniem funkcji wydalniczej nerek.
Dzienne zapotrzebowanie na chlor wynosi około 5000 mg. Chlor dostaje się do organizmu człowieka głównie w postaci chlorku sodu po dodaniu do żywności.
^
3. Pierwiastki śladowe, ich charakterystyka
Żelazo. Pierwiastek ten jest niezbędny do biosyntezy związków zapewniających oddychanie, hematopoezę; uczestniczy w reakcjach immunobiologicznych i redoks; jest częścią cytoplazmy, jąder komórkowych i szeregu enzymów.
Asymilacji żelaza zapobiegają kwas szczawiowy i fityna. Do przyswojenia tego składnika odżywczego potrzebna jest witamina B12. Kwas askorbinowy również przyczynia się do wchłaniania żelaza, ponieważ żelazo jest wchłaniane w postaci dwuwartościowego jonu.
^ Brak żelaza w organizmie może prowadzić do rozwoju anemii, wymiany gazowej, oddychania komórkowego, czyli zaburzeń podstawowych procesów zapewniających życie. Powstawaniu stanów niedoboru żelaza sprzyjają: niedostateczne spożycie żelaza w organizmie w postaci przyswojonej, zmniejszenie czynności wydzielniczej żołądka, niedobór witamin (zwłaszcza B 12 , kwas foliowy i askorbinowy) oraz szereg chorób powodujących utratę krwi.
Zapotrzebowanie na żelazo osoby dorosłej (14 mg/dzień) jest pokrywane w nadmiarze przez normalną dietę. Jednak w przypadku stosowania w żywności chleba z mąki szlachetnej, zawierającej niewielką ilość żelaza, bardzo często obserwuje się niedobór żelaza u mieszkańców miast. Jednocześnie należy wziąć pod uwagę, że produkty zbożowe bogate w fosforany i fitynę tworzą z żelazem trudno rozpuszczalne związki i zmniejszają jego przyswajalność przez organizm.
Żelazo jest powszechnym pierwiastkiem. Występuje w podrobach, mięsie, jajach, fasoli, warzywach, jagodach. Natomiast w postaci łatwo przyswajalnej żelazo występuje tylko w produktach mięsnych, wątrobie (do 2000 mg/100 g produktu), żółtku jaja.
Miedź. Miedź jest niezbędnym elementem metabolizmu człowieka, odgrywa rolę w tworzeniu czerwonych krwinek, uwalnianiu żelaza w tkankach oraz rozwoju szkieletu, ośrodkowego układu nerwowego i tkanki łącznej.
Ponieważ miedź jest szeroko rozpowszechniona w żywności, jest mało prawdopodobne, aby ludzie, z wyjątkiem niemowląt, na diecie czysto mlecznej, kiedykolwiek rozwinęli niedożywienie związane z miedzią.
Spożycie przez człowieka zbyt dużych dawek miedzi prowadzi do podrażnienia i erozji błon śluzowych, rozległego uszkodzenia naczyń włosowatych, uszkodzenia wątroby i nerek oraz podrażnienia ośrodkowego układu nerwowego. Dzienne zapotrzebowanie na ten pierwiastek to około 2 mg. Źródłem miedzi są pokarmy takie jak wątroba, żółtko jaja, zielone warzywa.
Jod. Jod jest niezbędnym pierwiastkiem biorącym udział w tworzeniu hormonu tyroksyny. Wraz z niedoborem jodu rozwija się wole - choroba tarczycy.
Zapotrzebowanie na jod waha się od 100-150 mcg dziennie. Zawartość jodu w środkach spożywczych jest zwykle niska (4-15 µg%). Owoce morza są najbogatsze w jod. Tak więc w rybach morskich zawiera około 50 mcg/100 g, w wątrobie dorsza do 800, w wodorostach w zależności od rodzaju i terminu zbioru – od 50 mcg do 70 000 mcg/100 g produktu. Należy jednak wziąć pod uwagę, że podczas długotrwałego przechowywania i obróbki cieplnej żywności tracona jest znaczna część jodu (od 20 do 60%).
Zawartość jodu w lądowych produktach roślinnych i zwierzęcych jest silnie uzależniona od jego ilości w glebie. Na obszarach, gdzie w glebie jest mało jodu, jego zawartość w produktach spożywczych może być 10 do 100 razy mniejsza niż średnia. Dlatego w tych obszarach aby zapobiec powstawaniu wola, do soli kuchennej dodaje się niewielką ilość jodanu potasu (25 mg na 1 kg soli). Okres przechowywania takiej jodowanej soli nie przekracza 6 miesięcy, ponieważ jod stopniowo zanika podczas przechowywania soli.
Fluor. Przy braku tego pierwiastka rozwija się próchnica (zniszczenie szkliwa zębów). Nadmiar fluoru ma również negatywny wpływ na organizm, ponieważ sole fluoru gromadzące się w kościach powodują zmianę koloru i kształtu zębów, osteochondrozę, a po tym zgrubieniu stawów i ich unieruchomieniu, narośla kostne. Różnica między użytecznymi a szkodliwymi dawkami fluoru jest tak mała, że wielu badaczy sprzeciwia się fluoryzacji wody.
Fluor spożywany z wodą jest wchłaniany prawie całkowicie, fluor zawarty w pożywieniu jest wchłaniany w mniejszym stopniu. Wchłonięty fluor jest równomiernie rozprowadzany po całym organizmie. Zatrzymywany jest głównie w szkielecie, a niewielka ilość odkłada się w tkance zęba. W dużych dawkach fluor może powodować zaburzenia metabolizmu węglowodanów, lipidów, białek, a także metabolizm witamin, enzymów i soli mineralnych.
W różnych krajach dokonano oszacowań dziennego spożycia fluoru z pożywienia; dla dorosłych wartość ta waha się od 0,2 do 3,1 mg, dla dzieci Grupa wiekowa od 1 roku do 3 lat spożycie fluoru oszacowano na 0,5 mg/dobę.
Prawie wszystkie produkty spożywcze zawierają co najmniej śladowe ilości tego pierwiastka. Wszystkie rodzaje roślinności zawierają pewną ilość fluoru, który pozyskują z gleby i wody. Wysoki poziom fluoru stwierdzono w niektórych produktach spożywczych, zwłaszcza w rybach, niektórych warzywach i herbacie. Stosowanie fluorowanej wody w zakładach przetwórstwa spożywczego często może podwoić poziom fluoru w gotowych produktach.
Do profilaktyki i leczenia próchnicy różne pasty do zębów, proszki, eliksiry, gumy do żucia i tym podobne, które zawierają dodany fluor, głównie w postaci nieorganicznej. Związki te są powszechnie włączane do środków do czyszczenia zębów, zwykle w stężeniach około 1 g/kg.
Chrom. Pierwiastek ten wydaje się być niezbędny do metabolizmu glukozy i lipidów oraz do wykorzystania aminokwasów przez niektóre układy. On także ma znaczenie do zapobiegania łagodnym postaciom cukrzycy i miażdżycy u ludzi.
Chrom jest wchłaniany zarówno z przewodu pokarmowego, jak iz dróg oddechowych. Wchłonięta ilość nie jest jednakowa dla każdego z tych systemów i zależy od postaci chromu. Chrom trójwartościowy jest podstawową formą pierwiastka dla ludzi, chrom sześciowartościowy jest toksyczny. Chrom jest rozprowadzany w tkankach organizmu człowieka w nierównych, ale zazwyczaj niskich stężeniach. Poziom chromu we wszystkich tkankach z wyjątkiem płuc zmniejsza się wraz z wiekiem. Największe ilości chromu u ludzi gromadzą się w skórze, mięśniach i tkance tłuszczowej. Mechanizmy homeostatyczne, w tym mechanizmy transportu w wątrobie i jelitach, zapobiegają nadmiernemu gromadzeniu się chromu trójwartościowego. Chrom jest powoli wydalany z organizmu, głównie z moczem.
Dziś za normę uważa się spożycie około 150 mg chromu dziennie. Jest szczególnie przydatny dla osób starszych, których organizm nie wchłania dobrze węglowodanów, a chrom usprawnia procesy metaboliczne tych właśnie związków. Chrom nieorganiczny jest słabo wchłaniany, dużo łatwiej – w związkach organicznych, czyli w takiej postaci, w jakiej występuje w organizmach żywych.
Produkty spożywcze różnią się znacznie zawartością chromu, która waha się od 20 do 550 µg/kg. Bogatym źródłem chromu są drożdże piwne, wątroba (10-80 mcg/100 g). W mniejszych ilościach pierwiastek ten znajduje się w ziemniakach ze skórkami, wołowinie, świeżych warzywach, pieczywie pełnoziarnistym, serze.
Mangan. Mangan jest niezbędnym kofaktorem w wielu układach enzymatycznych; odgrywa rolę w prawidłowym funkcjonowaniu flawoprotein, w syntezie siarczanowanych mukopolisacharydów, cholesterolu, hemoglobiny oraz w wielu innych procesach metabolicznych. Ze spożytego manganu wchłania się tylko około 3%.
Wchłanianie manganu jest ściśle związane z wchłanianiem żelaza. Zapotrzebowanie na mangan wynosi 0,2-0,3 mg na 1 kg wagi człowieka dziennie. Najwięcej manganu znajduje się w żurawinie i herbacie, nieco mniej w kasztanach, kakao, warzywach, owocach (100-200 mcg/100 g).
^ Nikiel. Nikiel został uznany za niezbędny pierwiastek śladowy stosunkowo niedawno. Obecnie ustalono jego rolę jako koenzymu w procesach metabolizmu żelaza. Jednocześnie wzrostowi spożycia żelaza w organizmie towarzyszy wzrost zapotrzebowania na nikiel pokarmowy. Ponadto nikiel przyczynia się do wchłaniania miedzi – kolejnego pierwiastka niezbędnego do hematopoezy. Znaczenie niklu spożywczego lub niklu wyizolowanego z produktów naturalnych podkreśla fakt, że syntetyczne związki tego pierwiastka są rakotwórcze.
Nikiel jest obecny w większości produktów spożywczych, ale w stężeniach poniżej (a często znacznie poniżej) 1 mg/kg. Stwierdzono, że spożycie niklu w diecie waha się od mniej niż 200 do 900 µg/dzień. Przy normalnej diecie wchodzi około 400 mcg / dzień. Wykazano, że zawartość niklu w winach i piwie wynosi odpowiednio 100 i 50 µg/L.
Cynk. Ten pierwiastek śladowy jako koenzym bierze udział w wielu reakcjach biosyntezy białek (ponad 70) i metabolizmu kwasów nukleinowych (w tym w procesach replikacji i transkrypcji DNA), które przede wszystkim zapewniają organizmowi wzrost i dojrzewanie. Jednocześnie cynk wraz z manganem jest specyficznym pierwiastkiem śladowym, który wpływa na stan funkcji seksualnych, a mianowicie na aktywność niektórych hormonów płciowych, spermatogenezę, rozwój męskich gonad oraz drugorzędowe cechy płciowe. Ponadto ostatnio rozważano rolę cynku w zapobieganiu procesom przerostowym gruczołu krokowego.
Cynk wraz z siarką bierze udział we wzroście i odnowie skóry i włosów. Wraz z manganem i miedzią cynk znacząco przyczynia się do odczuwania odczuć smakowych i zapachowych. Cynk jako niezbędny składnik wchodzi w skład cząsteczki insuliny, a jego poziom jest obniżony u pacjentów z cukrzycą. Bardzo ważne jest, aby ten pierwiastek śladowy był koenzymem dehydrogenazy alkoholowej, która zapewnia metabolizm alkoholu etylowego. Jednocześnie znacznie zmniejsza się poziom wchłaniania cynku w przewlekłym alkoholizmie. Tak zwana „nocna ślepota” (czyli upośledzenie widzenia w nocy) może rozwinąć się nie tylko przy braku witaminy A, ale także cynku. Cynk wraz z witaminą B 6 zapewnia metabolizm nienasyconych kwasów tłuszczowych oraz syntezę prostaglandyn.
Cynk jest bardzo ważny dla trawienia i wchłaniania składników odżywczych. Tak więc cynk zapewnia syntezę najważniejszych enzymów trawiennych w trzustce, a także bierze udział w tworzeniu chylomikronów – cząstek transportujących, w których tłuszcze pokarmowe mogą być wchłaniane do krwi. Cynk wraz z witaminami z grupy B jest ważnym regulatorem funkcji układu nerwowego. W warunkach niedoboru cynku mogą wystąpić zaburzenia emocjonalne, niestabilność emocjonalna, drażliwość, a w bardzo ciężkich przypadkach dysfunkcja móżdżku. Wreszcie, coraz więcej danych gromadzą się na korzyść udziału cynku w procesach dojrzewania limfocytów i reakcjach odporności komórkowej.
Dzienne zapotrzebowanie na cynk to 8000-22000 mcg%. Jest całkiem zadowolona ze zwykłej diety. Średnie dzienne spożycie cynku z samą wodą pitną wynosi około 400 mcg. Zawartość cynku w produktach spożywczych zwykle waha się w granicach 150-25000 mcg%. Natomiast w wątrobie, mięsie i roślinach strączkowych sięga 3000 – 5000 mcg%. Czasami niedobór cynku może wystąpić w organizmie dzieci i młodzieży, które nie spożywają wystarczającej ilości produktów pochodzenia zwierzęcego.
^ Selen. Nawet w połowie XX wieku. Selen nie tylko nie był brany pod uwagę przez nauki o żywieniu, ale był nawet uważany za bardzo toksyczny pierwiastek o właściwościach rakotwórczych. Jednak już w latach 60-tych. okazało się, że przy braku selenu cierpi układ sercowo-naczyniowy, co objawia się postępującą miażdżycą i osłabieniem mięśnia sercowego, aw stanach przewlekłego niedoboru selenu może rozwinąć się prawie nieuleczalna kardiomiopatia. Ostatnio na poziomie współczesne badania znajduje potwierdzenie jednej z ważnych obserwacji starożytnej medycyny chińskiej, wskazującej, że odpowiednie zaopatrzenie organizmu w selen pomaga spowolnić procesy starzenia i prowadzi do długowieczności . Warto zauważyć, że słynne lecznicze odmiany zielonej herbaty, dostarczane w celu osiągnięcia zdrowia i długowieczności w cesarskich pałacach w Starożytne Chiny, uprawiano w tych górskich prowincjach, w glebach których wysoka zawartość selenu jest już oznaczana nowoczesnymi metodami analitycznymi.
Po odkryciu selenu stwierdzono, że witamina E i selen działają na różne części tego samego procesu i są ściśle komplementarne, to znaczy ich aktywność przeciwutleniająca dramatycznie wzrasta, gdy są stosowane razem. Synergia obu przeciwutleniaczy jest szczególnie interesująca w kontekście działania przeciwnowotworowego. Wykazano zatem, że podawanie preparatów selenu jednocześnie z witaminą E istotnie zwiększało działanie przeciwnowotworowe w stosunku do guzów doświadczalnych.
Spożycie selenu z pokarmem zależy od warunków i charakteru przyjmowania pokarmu oraz poziomu selenu w produktach spożywczych. Warzywa i owoce są na ogół ubogim źródłem selenu, w przeciwieństwie do zbóż, produktów zbożowych, mięsa (zwłaszcza produktów ubocznych), owoców morza, które zawierają znaczne ilości selenu, zazwyczaj znacznie powyżej 0,2 mg/kg mokrej masy . Skład chemiczny Gleba i zawartość w niej selenu istotnie wpływają na ilość selenu w ziarnie, wahającą się od 0,04 mg/kg do 21 mg/kg.
Molibden. Całkowita ilość molibdenu w ciele osoby dorosłej wynosi około 7 mg. Zawartość molibdenu we krwi wynosi około 0,5 mikrograma na 100 ml. Wyższe stężenia tego pierwiastka stwierdzono u ludzi żyjących w rejonach, gdzie gleba jest najbogatsza w związki tego metalu. Tak więc w niektórych regionach Armenii odnotowano częste przypadki dny moczanowej wśród mieszkańców spożywających głównie lokalne produkty, w których stwierdzono niezwykle wysoki poziom molibdenu. Jego zawartość w diecie mieszkańców tego regionu wynosiła 10-15 mg. W innych rejonach, gdzie przypadki dny moczanowej występowały rzadziej, ludzie otrzymywali tylko 1-2 mg molibdenu dziennie z pożywienia.
Molibden jest integralną częścią wielu enzymów, takich jak oksydaza ksantynowa, oksydaza aldehydowa, oksydaza siarczanowa. Wiadomo, że molibden hamuje rozwój próchnicy.
Szacowane dzienne zapotrzebowanie na molibden wynosi 2 mcg na 1 kg masy ciała. W Rosji dzienne spożycie molibdenu wynosi 0,27 mg.
najbogatszy w molibden Różne rodzaje warzywa (takie jak rośliny strączkowe) i narządy wewnętrzne zwierząt.
Kobalt. Biologiczne działanie kobaltu znane jest od 1948 roku, kiedy naukowcy Rickes i Smith odkryli, że atom kobaltu jest centralnym elementem cząsteczki witaminy B 12. Maksymalne stężenie kobaltu w tkankach wynosi około 100 μg/kg. Całkowita zawartość kobaltu w ciele osoby dorosłej wynosi 5 mg. Osoba z jedzeniem codziennie otrzymuje 5,63-7,94 mikrogramów kobaltu, z czego 73-97% jest wchłaniane.
Średnie dzienne zapotrzebowanie na kobalt wynosi 60 mcg na 1 kg masy ciała. Uważa się, że człowiek potrzebuje kobaltu tylko w postaci cyjanokobalaminy (witamina B 12). W niektórych krajach związki kobaltu stosuje się jako dodatek do żywności do piwa w celu stabilizacji piany. Okazało się jednak, że taki dodatek był przyczyną chorób serca u konsumentów piwa. Dlatego obecnie zrezygnowano ze stosowania związków kobaltu jako dodatku do żywności.
^
4 Wpływ przetwarzania na skład mineralny żywności
Podczas przetwarzania surowców spożywczych z reguły zmniejsza się zawartość substancji mineralnych (z wyjątkiem Na, dodawanego w postaci soli spożywczej). W pokarmach roślinnych są tracone wraz z odpadami. Spada więc zawartość szeregu makro-, a zwłaszcza mikroelementów podczas produkcji zbóż i mąki po obróbce zbóż, gdyż tych składników jest więcej w usuniętych łupinach i zarodkach niż w całym ziarnie. Analiza porównawcza skład mineralny w mące pszennej najwyższej jakości oraz mące z pełnego ziarna podano poniżej (zawartość pierwiastków podana jest w mg/100 g produktu):
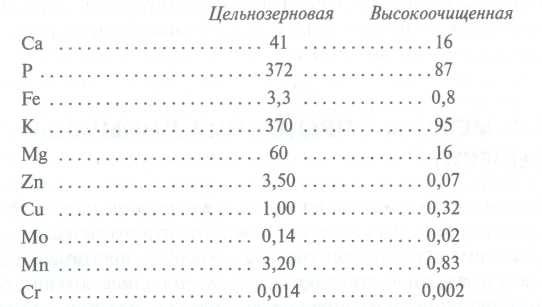
Na przykład ziarno pszenicy i żyta zawiera średnio ok. 1,7% składników popiołu, natomiast w mące, w zależności od odmiany, od 0,5 (w najwyższej jakości) do 1,5% (w mące razowej). Podczas czyszczenia warzyw i ziemniaków traci się od 10 do 30% minerałów. Jeśli są poddawane gotowaniu na gorąco, to w zależności od technologii (gotowanie, smażenie, duszenie) traci się kolejne 5 do 30%.
Mięso, produkty rybne i drób najczęściej tracą makroelementy, takie jak wapń i fosfor, podczas oddzielania miazgi od kości.
Podczas gotowania termicznego (gotowanie, smażenie, duszenie) mięso traci od 5 do 50% składników mineralnych. Jeśli jednak przetwarzanie odbywa się w obecności kości zawierających dużo wapnia, możliwe jest zwiększenie zawartości wapnia w gotowanych produktach mięsnych o 20%.
W procesie technologicznym, ze względu na niewystarczająco wysokiej jakości sprzęt, pewna ilość mikroelementów może przejść do produktu końcowego. Tak więc, robiąc chleb podczas przygotowywania ciasta w wyniku kontaktu ciasta z urządzeniami zawartość żelaza można zwiększyć o 30%. Proces ten jest niepożądany, ponieważ toksyczne pierwiastki zawarte w postaci zanieczyszczeń w metalu mogą również przedostać się do produktu wraz z żelazem. Gdy żywność w puszkach jest przechowywana w prefabrykowanych puszkach (czyli lutowanych) puszkach ze słabą jakością lutowia lub jeśli warstwa lakieru ochronnego zostanie zerwana, do produktu mogą przedostać się wysoce toksyczne pierwiastki, takie jak ołów, kadm i cyna.
Należy wziąć pod uwagę, że szereg metali, takich jak żelazo i miedź, nawet w niewielkich stężeniach, może powodować niepożądane utlenianie produktów. Ich zdolności katalitycznego utleniania są szczególnie wyraźne w stosunku do tłuszczów i produktów tłuszczowych. I tak np. przy stężeniu żelaza powyżej 1,5 mg/kg i miedzi 0,4 mg/kg podczas długotrwałego przechowywania masła i margaryn metale te powodują jełczenie produktów. Podczas przechowywania napojów w obecności żelaza powyżej 5 mg/l i miedzi 1 mg/l w pewnych warunkach często można zaobserwować zmętnienie napojów.
^
5. Metody oznaczania substancji mineralnych
Do analizy substancji mineralnych stosuje się głównie metody fizykochemiczne - optyczne i elektrochemiczne.
Niemal wszystkie te metody wymagają specjalnego przygotowania próbek do analizy, które polega na wstępnej mineralizacji przedmiotu badań. Mineralizację można przeprowadzić na dwa sposoby: „na sucho” i „na mokro”. Mineralizacja „na sucho” polega na zwęgleniu, spaleniu i kalcynowaniu próbki testowej w określonych warunkach. Mineralizacja „na mokro” przewiduje również obróbkę przedmiotu badań stężone kwasy(najczęściej HNO 3 i H 2 SO 4).
^ Spektralne metody analizy.
Fotoelektrokolorymetria - analiza oparta na pomiarze absorpcji przez kolorowe roztwory promieniowania monochromatycznego w zakresie widzialnym widma. Pomiary wykonuje się za pomocą kolorymetrów fotoelektrycznych wyposażonych w filtry wąskopasmowe. Jeżeli substancja badana nie jest zabarwiona, musi zostać przekształcona w barwny związek poprzez reakcję chemiczną z pewnymi odczynnikami (analityczna reakcja fotometryczna).
Spektrofotometria to metoda analityczna oparta na pomiarze absorpcji promieniowania monochromatycznego w zakresie ultrafioletowym, widzialnym i podczerwonym widma. Pomiary takie wykonuje się za pomocą spektrofotometrów, w których jako monochromatyzatory stosuje się pryzmaty dyspersyjne i siatki dyfrakcyjne.
Analizę ilościową badanego jonu zwykle przeprowadza się metodą krzywej kalibracyjnej.
Analiza widmowa emisji. Metody analizy widmowej emisji opierają się na pomiarze długości fali, natężenia i innych właściwości światła emitowanego przez atomy i jony substancji w stanie gazowym. Analiza spektralna emisji umożliwia określenie składu pierwiastkowego substancji nieorganicznych i organicznych.
Intensywność linii widmowej jest określona przez liczbę wzbudzonych atomów w źródle wzbudzenia, która zależy nie tylko od stężenia pierwiastka w próbce, ale również od warunków wzbudzenia. Przy stabilnej pracy źródła wzbudzenia zależność między natężeniem linii widmowej a koncentracją pierwiastka (jeśli jest wystarczająco mała) jest liniowa, tj. w ta sprawa analizę ilościową można również przeprowadzić metodą krzywej kalibracyjnej.
Największe zastosowanie jako źródło wzbudzenia otrzymał łuk elektryczny, iskra, płomień. Temperatura łuku sięga 5000 - 6000°C. W łuku można uzyskać widmo prawie wszystkich pierwiastków. Przy wyładowaniu iskrowym rozwija się temperatura 7000 - 10000 ° C i wszystkie pierwiastki są wzbudzane. Płomień daje wystarczająco jasne i stabilne widmo emisji. Metoda analizy wykorzystująca płomień jako źródło wzbudzenia nazywana jest analizą emisji płomienia. Metoda ta oznacza ponad czterdzieści pierwiastków (ziemi alkalicznych i alkalicznych, Cu 2 , Mn 2 itp.).
^ Spektroskopia absorpcji atomowej . Metoda opiera się na zdolności wolnych atomów pierwiastków w gazach płomieniowych do pochłaniania energii świetlnej o długości fali charakterystycznej dla każdego pierwiastka.
W atomowej spektroskopii absorpcyjnej możliwość nakładania się linii widmowych różnych pierwiastków jest prawie całkowicie wykluczona, ponieważ ich liczba w widmie jest znacznie mniejsza niż w spektroskopii emisyjnej.
Spadek natężenia promieniowania rezonansowego w warunkach atomowej spektroskopii absorpcyjnej jest zgodny z wykładniczym prawem spadku natężenia w zależności od grubości warstwy i stężenia substancji, podobnym do prawa Bouguera-Lamberta-Beera
Niezmienność grubości warstwy pochłaniającej światło (płomień) uzyskuje się za pomocą palników o specjalnej konstrukcji. Metody analizy spektralnej absorpcji atomowej są szeroko stosowane do analizy niemal każdego obiektu technicznego lub przyrodniczego, zwłaszcza w przypadkach, gdy konieczne jest oznaczenie niewielkich ilości pierwiastków.
Opracowano metody oznaczania absorpcji atomowej dla ponad 70 pierwiastków.
^ 2. Elektrochemiczne metody analizy.
Jonometria. Metoda służy do oznaczania jonów K , Na , Ca 2 , Mn 2 , F - , I - , Сl - itp.
Metoda opiera się na zastosowaniu elektrod jonoselektywnych, których membrana przepuszcza określony rodzaj jonów (stąd z reguły wysoka selektywność metody).
Zawartość ilościową oznaczanego jonu przeprowadza się albo za pomocą wykresu kalibracyjnego, który wykreśla się we współrzędnych E - pC, albo metodą dodawania. Standardowa metoda dodawania jest zalecana do oznaczania jonów w złożonych układach zawierających duże stężenia substancji obcych.
Polarografia. Metodę polarografii prądu przemiennego stosuje się do oznaczania pierwiastków toksycznych (rtęć, kadm, ołów, miedź, żelazo).
Metoda opiera się na badaniu krzywych prąd-napięcie uzyskanych podczas elektrolizy substancji elektrooksydacyjnej lub elektroredukującej. Jako elektrodę wskaźnikową w polarografii stosuje się najczęściej rtęciową elektrodę kroplową, czasem mikroelektrody stałe - platynowe, grafitowe. Jako elektrodę odniesienia stosuje się rtęć wylewaną na dno elektrolizera lub nasyconą półogniwo kalomelowe.
Wraz ze wzrostem napięcia następuje moment, w którym wszystkie jony wchodzące do elektrody w wyniku dyfuzji są natychmiast rozładowywane, a ich stężenie w warstwie przyelektrodowej staje się stałe i praktycznie równe zeru. Prąd płynący w tym czasie w obwodzie nazywany jest ograniczającym prądem dyfuzyjnym.
Ilościowa analiza polarograficzna opiera się na wykorzystaniu bezpośredniej zależność proporcjonalna wielkość prądu dyfuzyjnego na stężenie oznaczanego pierwiastka.
^ ELEMENTY MINERALNE
Pierwiastki mineralne (popioły) występują w produktach spożywczych w postaci związków organicznych i nieorganicznych. Występują w wielu organicznych
substancje różnych klas - białka, tłuszcze, glikozydy, enzymy itp. Zazwyczaj w popiele po spaleniu produktów spożywczych określa się pierwiastki mineralne, ponieważ trudno jest dokładnie określić, jakie substancje i w jakiej ilości są zawarte.
Rola pierwiastków mineralnych w życiu ludzi, zwierząt i roślin jest ogromna: wszystkie procesy fizjologiczne w organizmach żywych przebiegają z udziałem tych pierwiastków. Tak więc w ciele ludzkim i zwierzęcym pierwiastki mineralne biorą udział w procesach plastycznych, tworzeniu i budowie tkanek, w metabolizmie wody, w utrzymaniu ciśnienia osmotycznego krwi i innych płynów ustrojowych, w utrzymaniu równowagi kwasowo-zasadowej w organizmie oraz są zawarte w kompleksie substancji tworzących żywe komórki protoplazmy, w składzie niektórych gruczołów dokrewnych itp.
Skład mineralny organizmów zmienia się wraz z wiekiem; wraz z wiekiem obserwuje się mineralizację organizmów. Tak więc noworodki zawierają około 34 g minerałów na 1 kg masy ciała, u osoby dorosłej zawartość tych substancji wzrasta do 43 g lub więcej.
W organizmie ludzkim i zwierzęcym znaleziono ponad 70 pierwiastków mineralnych. Wiele procesów enzymatycznych zachodzących w różnych tkankach organizmu wymaga udziału szeregu pierwiastków mineralnych. Tak więc do konwersji kwasu pirogronowego do kwasu octowego lub glukozy do fruktozy lub fosfoglicerolu do glukozo-6-mannozy-6- i fruktozo-6-fosforanu niezbędny jest udział jonów magnezu. Jony wapnia hamują rozwój tego procesu.
Minerały są nierównomiernie rozmieszczone w tkankach ludzkiego ciała. W tkankach twardych dominują pierwiastki dwuwartościowe: wapń (Ca) i magnez (Mg), aw tkankach miękkich pierwiastki jednowartościowe: potas (K) i sód (Na). Ponadto w tkankach twardych gromadzi się dużo fosforu (P), głównie w postaci soli fosforanowych. Przy braku minerałów w pożywieniu związki te są wydalane z organizmu i zaburzony jest normalny metabolizm.
Substancje mineralne rozpuszczone w osoczu krwi, płynach międzykomórkowych i innych płynach ustrojowych wytwarzają określone ciśnienie osmotyczne, które zależy od stężenia molowego substancji rozpuszczonych w płynie. Sole w większym stopniu zwiększają ciśnienie osmotyczne
niż nieelektrolity przy tym samym stężeniu molowym, ponieważ sole dysocjują, tworząc jony. Ciśnienie osmotyczne zależy od całkowitej liczby niezdysocjowanych cząsteczek i jonów. Ciśnienie osmotyczne krwi, limfy i płynu międzykomórkowego organizmu ludzkiego i zwierzęcego zależy głównie od rozpuszczonego w nich chlorku sodu (NaCl).
Ciśnienie osmotyczne w płynach ustrojowych wpływa na dystrybucję wody i substancji rozpuszczonych w tkankach. U zwierząt wyższych ciśnienie osmotyczne jest stałe i wynosi 7,5 - 9,0 atm. Utrzymanie stałego ciśnienia osmotycznego zapewnia aktywność narządów wydalniczych, głównie nerek i gruczołów potowych.
Wnikanie soli mineralnych do krwi prowadzi do wnikania wody międzykomórkowej do krwi, a tym samym zmniejsza się stężenie soli we krwi. Nadmiar wody i soli jest następnie usuwany przez nerki. Zmniejszenie ilości wody w tkankach, działające odruchowo na ośrodki nerwowe, powoduje pragnienie.
Normalna aktywność życiowa organizmu ludzkiego może przebiegać tylko z pewnymi właściwościami płynów międzykomórkowych i śródmiąższowych. W tej niezmienności środowiska ważną rolę odgrywa równowaga kwasowo-zasadowa, w której odczyn krwi, limfy i innych płynów ustrojowych jest zbliżony do obojętnego. Równowaga kwasowo-zasadowa jest utrzymywana przez skomplikowany system regulatory połączone w jedną centralę system nerwowy. Takimi regulatorami są układy buforowe krwi, wymiana tlenu i dwutlenku węgla, soli dwutlenku węgla i chlorków, funkcje wydalnicze nerek, płuc, gruczołów potowych itp.
W procesie złożonej przemiany w organizmie człowieka produktów bogatych w wapń, magnez, sód czy potas mogą powstawać związki alkaliczne. Źródłami pierwiastków alkalizujących są owoce, warzywa, rośliny strączkowe, mleko i produkty mleczne.
Inne produkty, takie jak mięso, ryby, jajka, sery, pieczywo, płatki zbożowe, makarony w procesie przemiany w organizmie człowieka dają związki kwaśne.
Charakter żywienia może wpływać na zmiany równowagi kwasowo-zasadowej w tkankach ludzkiego ciała. Równowaga kwasowo-zasadowa często przesuwa > stronę kwasowości. W wyniku gwałtownej zmiany
dopuszczalnych maksymalnych norm zawartości popiołu, a przy ocenie takich produktów określają jego ilość.
Zwykle rozróżnia się dwa pojęcia - „całkowity (surowy) popiół” i „czysty popiół”. Pojęcie „popiół całkowity” oznacza sumę pierwiastków mineralnych lub ich tlenków, które są zawarte w strukturze chemicznej produktów spożywczych, a także wprowadzone do produktu podczas jego produkcji lub „przypadkowo wychwycone jako zanieczyszczenia”. „Czysty popiół” oznacza suma pierwiastków mineralnych lub ich tlenków bez zanieczyszczeń.
Zawartość popiołu w produkcie określa się przez spalanie. Aby to zrobić, próbka jest najpierw ostrożnie spalana, a następnie kalcynowana do stałej masy. Podwyższona ilość popiołu wbrew normie wskazuje na zanieczyszczenie produktu piaskiem, drobinkami metalu i ziemią.
Aby określić „czysty popiół”, powstały popiół traktuje się 10% kwasem solnym. W takim przypadku „czysty popiół” rozpuszcza się w kwasie solnym, a pozostałość wskaże na obecność obcych nieorganicznych zanieczyszczeń w produkcie. Tak więc w przypadku złego mycia pomidorów przed przetwarzaniem lub w skrobi ziemniaczanej, przy niedostatecznym myciu bulw, występuje zwiększona ilość popiołu z powodu obcych zanieczyszczeń mineralnych.
Wapń w organizmie człowieka znajduje się w tkance kostnej i zębach – około 99%. Reszta wapnia dostaje się do krwi w postaci jonów oraz w stanie związanym z białkami i innymi związkami.
Dzienne zapotrzebowanie osoby dorosłej na wapń wynosi 0,8-1,0 g. Kobiety w ciąży i karmiące piersią potrzebują zwiększonej ilości wapnia do 1,5-2 g dziennie, a także dzieci, w których organizmach wapń jest intensywnie wykorzystywany do tworzenia kości. Niedobór wapnia powoduje deformację szkieletu, kruchość kości i zanik mięśni w organizmie. Wapń charakteryzuje się tym, że nawet przy braku pożywienia jest wydalany z organizmu w znacznych ilościach.
Wapń występuje w produktach spożywczych w postaci soli fosforanowych i chlorkowo-szczawianowych, a także w połączeniu z kwasami tłuszczowymi, białkami itp.
Wszystkie związki wapnia, z wyjątkiem CaC!a, są słabo rozpuszczalne w wodzie i dlatego są słabo wchłaniane
Ciało ludzkie. Nierozpuszczalne związki wapnia częściowo przechodzą z produktów do roztworu w żołądku pod wpływem kwasu solnego sok żołądkowy. Przyswajanie wapnia z produktów spożywczych przez organizm człowieka w dużej mierze zależy od obecności w pożywieniu fosforanów, tłuszczów, związków magnezu itp. Zatem przyswajanie wapnia jest największe, gdy stosunek wapnia do fosforu I w pożywieniu ; 1,5 lub 1:2. Ilość fosforu w pożywieniu zwiększona w stosunku do wskazanych proporcji prowadzi do gwałtownego spadku wchłaniania wapnia. Nadmiar magnezu wpływa również niekorzystnie na przyswajanie wapnia przez organizm człowieka. Zdecydowanie negatywny wpływ na przyswajanie wapnia mają związki wapnia z kwasem inozytolowo-fosforowym, który występuje w znacznych ilościach w ziarnach zbóż i produktach jego przetwarzania.
Witamina D odgrywa bardzo ważną rolę we wchłanianiu wapnia, co sprzyja przechodzeniu soli wapnia i fosforu z jelit do krwi i odkładaniu się w kościach w postaci fosforanu wapnia.
Zawartość wapnia w niektórych produktach spożywczych kształtuje się następująco (mg%): w chudym mięsie - 7; w jajach - 54; w mleku - 118; w serze - 930; w twarogu - 140; w płatkach owsianych - 65; w mące pszennej - 15; w ryżu - 9; w jabłkach - 7; w pomarańczach - 45; w orzechach włoskich -89; w burakach - 29; w kalafiorze - 89; w białej kapuście - 45; w marchwi - 56; w ziemniakach - 14. Z powyższych danych wynika, że najważniejszym źródłem wapnia dla człowieka są produkty mleczne. Wapń w produktach mlecznych, a także warzywach i owocach jest związkiem łatwo przyswajalnym.
Magnez w organizmie człowieka jest 30-35 razy mniejszy niż wapń, ale jest bardzo ważny. Większość magnezu znajduje się w tkance kostnej. Magnez odgrywa szczególną rolę w roślinach zawierających chlorofil, gdzie jest częścią cząsteczki chlorofilu. Podobnie jak wapń, magnez tworzy związki trudno rozpuszczalne. Magnez jest szczególnie trudny do przyswojenia w obecności jonu LO$.
Zawartość magnezu w niektórych produktach spożywczych kształtuje się następująco (mg%): w fasoli – 139; w płatkach owsianych - 133; w grochu - 107; w prosie - 87; w chlebie pszennym - 30; w ziemniakach - 28; w marchwi - 21; w białej kapuście -!Anna - 12; w jabłkach - 8; w cytrynach - 7; w wołowinie - 15; w jajkach - 11; w mleku - 12. W konsekwencji 2*35 magnezu znajduje się w największych ilościach w ziarnach i roślinach strączkowych.
Zapotrzebowanie na magnez dla osoby dorosłej wynosi 400 mg dziennie.
Sód jest powszechnie obecny w żywności, zwłaszcza w produktach pochodzenia zwierzęcego. Głównym źródłem sodu dla organizmu człowieka jest NaCt (sól kuchenna). Sód odgrywa ważną rolę w procesach metabolizmu wewnątrzkomórkowego i międzytkankowego. Około 90% ciśnienia osmotycznego osocza krwi zależy od zawartości w nim NaCl. Zazwyczaj 3,3 g sodu rozpuszcza się w litrze ludzkiego osocza krwi. NaC! Odgrywa również ważną rolę w regulowaniu metabolizmu wody w organizmie. Jony sodu powodują obrzęk koloidów tkankowych i tym samym przyczyniają się do zatrzymywania związanej wody w organizmie. Z ciała NaC! wydalany głównie z moczem i potem. Przy wzmożonej pracy i spożyciu płynów człowiek traci do 3-5 litrów potu, czyli 99,5% wody. W suchej masie potu głównym składnikiem jest NaGI.
Sól kuchenna, która dostaje się do organizmu człowieka wraz z pożywieniem, uzupełnia zużycie NaCl we krwi i służy do tworzenia kwasu solnego w soku żołądkowym, a także do syntezy NaHCO3 przez gruczoł trzustkowy. Obecność NaHCO3 wyjaśnia alkaliczny odczyn soku trzustkowego, który jest niezbędny do rozkładu białek pokarmowych przez enzym trypsynę.
Dzienne zapotrzebowanie osoby dorosłej na sód wynosi 4-6 g, co odpowiada 10-15 g soli kuchennej. Zwykłe diety ludności zawierają wystarczającą ilość sodu, ponieważ sól kuchenna jest dodawana do żywności.
Potas jest stale iw znacznych ilościach obecny w produktach spożywczych, zwłaszcza pochodzenia roślinnego.W popiołach roślinnych zawartość potasu czasami przekracza 50% jego masy.
W organizmie ludzkim potas bierze udział w reakcjach enzymatycznych, tworzeniu układów buforowych, które zapobiegają zmianom reakcji środowiska. Zmniejsza potas
Zdolność białek do zatrzymywania wody, zmniejszająca ich hydro-(zdolność), a tym samym sprzyja wydalaniu wody i sodu z organizmu, dlatego potas można uznać za pewnego fizjologicznego antagonistę sodu.
Dzienne zapotrzebowanie osoby dorosłej na potas wynosi 3-5 g.
Żelazo jest szeroko rozpowszechnione w przyrodzie. Ogólnie rzecz biorąc, prawie wszystkie naturalne produkty spożywcze zawierają żelazo, ale w niewielkich ilościach.
W organizmach ludzkich i zwierzęcych żelazo jest częścią najważniejszych związków organicznych - hemoglobiny we krwi, mioglobiny, niektórych enzymów - katalazy, peroksydazy, oksydazy cytochromowej itp. Hemoglobina we krwi zawiera 2A, żelazo organizmu. Znaczna ilość żelaza znajduje się w śledzionie i wątrobie. Żelazo ma zdolność gromadzenia się w organizmie. Hemoglobina we krwi ulega zniszczeniu podczas życia, a uwolnione w tym przypadku żelazo może zostać ponownie wykorzystane przez organizm do wytworzenia hemoglobiny.
Żelazo, które jest częścią owoców i warzyw, jest dobrze przyswajalne przez organizm ludzki, podczas gdy większość żelaza w produktach zbożowych jest w formie niestrawnej dla organizmu.
Dzienne zapotrzebowanie dorosłego ludzkiego gruczołu wynosi 15 mg.
l l lub r jest częścią żywności naturalnej w niewielkich ilościach. Produkty roślinne zawierają mało chloru, natomiast produkty pochodzenia zwierzęcego zawierają nieco więcej. Tak więc zawartość chloru w wołowinie wynosi 76 mg%, w mleku - 106, w jajach -
37106, w serze - 880, w kaszy jaglanej - 19, w ziemniakach - 54, w jabłkach - 5 mg%.
Zawartość chloru jest znacząca we krwi i innych płynach ustrojowych, a także w skórze, płucach i nerkach. Chlor w organizmie jest w stanie zjonizowanym w postaci anionów soli sodu, potasu, wapnia, magnezu, manganu. Związki chloru w produktach spożywczych są dobrze rozpuszczalne i łatwo wchłaniane w jelicie człowieka. Aniony chloru wraz z kationami sodu odgrywają ważną rolę w tworzeniu i regulacji ciśnienia osmotycznego krwi i innych płynów ustrojowych. Sole chloru zapewniają tworzenie kwasu solnego przez błonę śluzową żołądka.
Główne zapotrzebowanie na chlor zaspokaja chlorek sodu, który dodawany jest do żywności w postaci soli.
Całkowita ilość chlorku sodu w organizmie człowieka wynosi zwykle 10-15 g, ale podczas spożywania pokarmów bogatych w sole chloru zawartość chloru w organizmie człowieka może osiągnąć wyższą ilość. Dzienne zapotrzebowanie człowieka na chlor wynosi 5-7 g.
Siarka występuje w największych ilościach w produktach zbożowych, roślinach strączkowych, produktach mlecznych, mięsie, rybach, a zwłaszcza jajach. Wchodzi w skład prawie wszystkich białek ludzkiego organizmu i jest szczególnie bogata w aminokwasy – cystynę, metioninę. Wymiana siarki w organizmie to głównie jej przekształcenie we wskazane aminokwasy. Bierze również udział w tworzeniu witaminy Bg (tiaminy), insuliny i niektórych innych związków. Dużo siarki znajduje się w proteinoidach tkanek podporowych, na przykład w keratynie włosów, paznokci itp.
Kiedy związki ulegają utlenieniu w organizmie, znaczna część siarki jest wydalana z moczem w postaci soli kwasu siarkowego.
Dzienne zapotrzebowanie osoby dorosłej na siarkę przy umiarkowanej pracy wynosi około 1 g.
Jod zawarty jest w organizmie zdrowej osoby ważącej 70 kg w ilości około 25 mg. Połowa tej ilości znajduje się w tarczycy, a reszta w tkankach mięśniowych i kostnych oraz we krwi. Nieorganiczne związki jodu w tarczycy zostają zastąpione związki organiczne- tyroksyna, dijodotyroksyna, trijodotyroksyna. Jod jest szybko wchłaniany przez tarczycę i kilka godzin po dostaniu się do niego zamienia się w organiczny
znajomości. Związki te stymulują procesy metaboliczne w organizmie. Gdy niedostateczna ilość jodu dostanie się do organizmu wraz z pożywieniem, czynność tarczycy zostaje zaburzona i rozwija się poważna choroba zwana wole endemicznym.
Najwięcej jodu znajduje się w produktach roślinnych i zwierzęcych obszarów przybrzeżnych, gdzie koncentruje się w wodzie morskiej, powietrzu i glebie obszarów przybrzeżnych. Niewiele jodu kumuluje się w roślinach i organizmach zwierzęcych górskich lub oddalonych od wybrzeża morskiego rejonach jodu.
Zawartość jodu w produktach zbożowych, warzywach, rybach słodkowodnych nie przekracza 5-8 mcg na 100 g surowca. Wołowina, jajka, masło, owoce wyróżniają się wyższą zawartością jodu. jarmuż morski, ryby morskie i olej rybny zawierają najwięcej jodu. Owoce Feijoa rosnące na wybrzeżu Morza Czarnego w Gruzji gromadzą aż 390 mikrogramów jodu na 100 g masy owocowej, czyli znacznie więcej niż zawartość tego pierwiastka w innych owocach i warzywach.
Na obszarach, gdzie produkty spożywcze zawierają niewystarczające ilości jodu, do soli kuchennej dodaje się jodek potasu w ilości 25 g K1 na tonę soli kuchennej. Przy normalnej diecie osoba spożywa 200 mikrogramów jodu dziennie z solą jodowaną. Jednak podczas przechowywania soli jodowanej jod stopniowo zanika, dlatego po 6 miesiącach sól jodowana jest sprzedawana jako zwykła sól kuchenna.
Dzienne zapotrzebowanie człowieka na jod wynosi 100-260 mcg.
Fluor odgrywa ważną rolę w procesach plastycznych podczas tworzenia tkanki kostnej i szkliwa zębów. Najwięcej fluoru jest skoncentrowane w kościach - 200-490 mg/kg i zębach - 240-560 mg/kg.
Woda wydaje się być głównym źródłem fluoru w ludzkim organizmie, przy czym fluor Dody jest lepiej wchłaniany niż fluor spożywczy. Zawartość fluoru w wodzie pitnej waha się od 1 do 1,5 mg/l. Brak fluoru w wodzie często wpływa na
39nne do rozwoju choroby zębów, zwanej próchnicą. Nadmiar fluoru w wodzie powoduje fluorozę, w której zaburzona jest normalna struktura zębów, pojawiają się przebarwienia na szkliwie i wzrasta kruchość zębów. Dzieci szczególnie cierpią na niedobór lub nadmiar fluoru.
Codzienne zapotrzebowanie człowieka na fluor nie zostało jeszcze ustalone. Uważa się, że optymalna dla zdrowia ilość fluoru w wodzie pitnej powinna wynosić 0,5-1,2 mg/l.
Miedź w organizmie zwierzęcia wraz z żelazem odgrywa ważną rolę w procesach hematopoezy, stymuluje procesy oksydacyjne i tym samym jest związana z metabolizmem żelaza. Jest częścią enzymów (laktazy, oksydazy askorbinianowej, oksydazy cytochromowej itp.) jako składnik metaliczny.
W roślinach miedź usprawnia procesy oksydacyjne, przyspiesza wzrost i zwiększa plon wielu upraw.
W tych niewielkich ilościach, w których miedź znajduje się w produktach naturalnych, nie szkodzi ludzkiemu organizmowi. Ale podwyższone ilości miedzi mogą powodować zatrucie. Tak więc jednoczesne przyjmowanie 77-120 mg miedzi może powodować nudności, wymioty, a czasem biegunkę. Dlatego zawartość miedzi w produktach spożywczych regulują aktualne przepisy Ministerstwa Zdrowia ZSRR. Na 1 kg produktu, w zależności od zawartości w nim ciał stałych, dopuszcza się od 5 do 30 mg miedzi. Tak więc w koncentratach pomidorowych zawartość miedzi nie powinna przekraczać 30 mg / kg, w przecierze pomidorowym - 15-20, w warzywach konserwowych - 10, w dżemie i marmoladach - 10, w kompotach owocowych - 5 mg / kg.
Miedź może dostać się do produktów spożywczych podczas ich produkcji - z miedzianych części wyposażenia, podczas traktowania winnic pestycydami zawierającymi miedź itp.
Dzienne zapotrzebowanie osoby dorosłej na miedź wynosi 2 mg.
Cynk znajduje się we wszystkich tkankach zwierząt i roślin. Przy braku cynku w organizmach młodych kobiet,
U roślin ich wzrost jest opóźniony, a wraz z jego niedoborem w glebie dochodzi do chorób wielu roślin, co często prowadzi do ich śmierci.
Cynk wchodzi w skład wielu enzymów, a jego rola w cząsteczce enzymu anhydrazy węglanowej, która bierze udział w wiązaniu i wydalaniu dwutlenku węgla z organizmu zwierzęcia, jest szczególnie ważna. Cynk jest niezbędny do prawidłowego funkcjonowania hormonów przysadki, nadnerczy i trzustki. Wpływa również na metabolizm tłuszczów, zwiększając ich rozkład i zapobiegając stłuszczeniu wątroby.
Cynk w żywności w dużych ilościach może powodować zatrucie. Żywność kwaśna i tłusta rozpuszcza metaliczny cynk, dlatego gotowanie lub przechowywanie żywności w sprzęcie lub naczyniach cynkowych jest niedopuszczalne. Zatrucie cynkiem jest podobne do zatrucia miedzią, ale bardziej wyraźne i towarzyszy mu pieczenie i ból w jamie ustnej i żołądku, wymioty, biegunka i osłabienie serca. Przybory cynkowe są dozwolone tylko do przechowywania zimnej wody pitnej, ponieważ w tym przypadku rozpuszczalność cynku jest znikoma.
Dzienne zapotrzebowanie osoby dorosłej na cynk wynosi 10-15 mg. Podczas wzrostu i dojrzewania obserwuje się zwiększone zapotrzebowanie na cynk. Przy normalnej diecie osoba otrzymuje wystarczającą ilość cynku z pożywienia.
Ołów znajduje się w produktach pochodzenia zwierzęcego i roślinnego w bardzo małych ilościach. Tak więc w jabłkach, gruszkach, winogronach, truskawkach zawartość ołowiu wynosi około 0,1 mg na 1 kg produktu, w mleku - 0,8, w mięsie - 0,05, u jesiotra - 0,06 mg na 1 kg.
Ołów jest metalem toksycznym dla ludzi, ma zdolność gromadzenia się w organizmie, głównie w wątrobie i powoduje ciężkie przewlekłe zatrucia.
Przy codziennym stosowaniu 2-4 mg ołowiu z jedzeniem, oznaki zatrucia ołowiem mogą być wykryte już po kilku miesiącach.
41 Zanieczyszczenie żywności ołowiem może pochodzić z naczyń, lutów, glazury, sprzętu i środków owadobójczych zawierających ołów. Najczęściej do zatrucia ołowiem dochodzi, gdy żywność jest przechowywana w rzemieślniczych naczyniach ceramicznych, które nie są dobrze pokryte szkliwem ołowiowym.
Ze względu na wysoką toksyczność nie dopuszcza się zawartości ołowiu w produktach spożywczych.
Cyna występuje w produktach spożywczych w niewielkich ilościach. Tak więc 0,14 mg/kg cyny znaleziono w wątrobie byka i barana, 0,003 w nerkach, 0,63 w płucach i 0,019 mg/kg w mózgu.
Cyna nie jest tak toksycznym metalem jak ołów, cynk czy miedź, dlatego jest dozwolona w ograniczonych ilościach w wyposażeniu przedsiębiorstw spożywczych, a także do cynowania powierzchni cyny, z której przygotowywane są cynowe puszki, chroniąc ją przed korozją. Jednak często podczas długotrwałego przechowywania konserw w puszkach masa produktu wchodzi w interakcję z powłoką cyny cyny, w wyniku czego powstają sole cyny kwasów organicznych. Proces ten jest szczególnie aktywny, gdy w puszce znajdują się produkty o wysokiej kwasowości – owoce, konserwy rybne i warzywa sos pomidorowy i inne Podczas długotrwałego przechowywania zawartość cyny w puszkach może znacznie wzrosnąć. Zawartość cyny wzrasta szczególnie szybko w produktach, które znajdują się w otwartych metalowych puszkach pokrytych cyną.
Aby wzmocnić ochronę puszki przed korozją, na powierzchnię cyny nakłada się dodatkowo specjalne kwasoodporne lakiery lub emalię lub na powierzchni cyny tworzy się cienka warstwa stabilnych tlenków cyny.
Mangan jest szeroko rozpowszechniony w produktach pochodzenia zwierzęcego i roślinnego. Bierze czynny udział w tworzeniu wielu enzymów, tworzeniu kości, procesach hematopoezy oraz stymuluje wzrost. W roślinach mangan wzmaga proces fotosyntezy i tworzenia kwasu askorbinowego.
Produkty roślinne są w większości przypadków bogatsze w mangan niż produkty pochodzenia zwierzęcego. Tak więc zawartość manganu w produktach zbożowych sięga 1-15 mg na 1 kg w liściu
warzywa - 10-20, owoce - 0,5-1, mleko - 0,02-0,03, jaja - 0,1-0,2, w wątrobie zwierząt - 2,65-2,98 mg na 1 kg.
Przy braku manganu w glebie rośliny chorują i słabo się rozwijają, zmniejsza się plon owoców, warzyw i innych upraw. Dodanie do gleby mikronawozów zawierających mangan pomaga zwiększyć plon.
Dzienne zapotrzebowanie osoby dorosłej na mangan wynosi 5-10 mg dziennie.
Izotopy promieniotwórcze są obecne w ludzkim ciele, stale wchodzą i wychodzą z ciała. Istnieje równowaga między przyjmowaniem związków radioaktywnych do organizmu a ich usuwaniem z organizmu. Wszystkie produkty spożywcze zawierają radioaktywne izotopy potasu (K40), węgla (C14), wodoru (H3), a także rad wraz z produktami jego rozpadu.
Najwyższe stężenie przypada na potas (K40). Izotopy uczestniczą w metabolizmie wraz z nieradioaktywnymi.
Uważa się, że w najbliższym czasie geologicznym nie było dużych zmian w natężeniu promieniowania na Ziemi, a zatem u zwierząt i flora rozwinął rodzaj odporności na te poziomy promieniowania. Ale żywe organizmy są bardzo wrażliwe na podwyższone stężenia. Małe stężenia zwiększają wzrost organizmów żywych, duże stężenia powodują pojawienie się aktywnych rodników, w wyniku czego dochodzi do naruszenia czynności życiowych poszczególnych narządów i tkanek, a także całego organizmu.
Na wybuchy atomowe Izotopy radioaktywne opadają na powierzchnię Ziemi, zanieczyszczając atmosferę, wodę, glebę i rośliny. Poprzez żywność, atmosferę i wodę izotopy promieniotwórcze dostają się do ludzkiego ciała.
Ustalono, że gdy produkty spożywcze są poddawane działaniu promieniowania radioaktywnych izotopów, wydłuża się ich okres przydatności do spożycia, a kiełkowanie ziemniaków jest opóźnione. Zwykle jednak napromieniowana żywność może mieć specyficzny zapach i smak i możliwe jest tworzenie się substancji toksycznych. Aby określić bezpieczeństwo takich produktów, wymagane są długoterminowe eksperymenty.
pytania testowe
Jakie pierwiastki chemiczne to makroelementy?
Jakie funkcje pełnią minerały w ludzkim ciele?
Jaka jest rola wapnia w organizmie człowieka?
Jakie pierwiastki chemiczne zaliczane są do pierwiastków śladowych i jakie są ich funkcje w organizmie człowieka?
Jaką rolę odgrywa żelazo w ludzkim ciele iw jakich pokarmach się znajduje?
Jakie są konsekwencje niedoboru jodu w organizmie i jak można tego uniknąć?
Jakie rodzaje przetwarzania technologicznego surowców i produktów spożywczych przyczyniają się do utraty minerałów?
Podaj przykłady interakcji niektórych mikroelementów i witamin.
Jakie znasz metody oznaczania zawartości makro- i mikroelementów?
