Co szybciej nagrzewa się na kuchence - czajnik czy wiadro wody? Odpowiedź jest oczywista - czajnik. Następnie drugie pytanie brzmi: dlaczego?
Odpowiedź jest nie mniej oczywista – bo w czajniku masa wody jest mniejsza. W porządku. A teraz możesz sam zrobić w domu najbardziej realne doznania fizyczne. Aby to zrobić, potrzebujesz dwóch identycznych małych rondli, równej ilości wody i oleju roślinnego, na przykład pół litra i pieca. Umieść garnki z olejem i wodą na tym samym ogniu. A teraz tylko patrz, co szybciej się nagrzeje. Jeśli jest termometr do płynów, możesz go użyć, jeśli nie, możesz po prostu od czasu do czasu sprawdzać temperaturę palcem, tylko uważaj, aby się nie poparzyć. W każdym razie wkrótce zobaczysz, że olej nagrzewa się znacznie szybciej niż woda. I jeszcze jedno pytanie, które można również zrealizować w formie doświadczenia. Co szybciej się gotuje - ciepła woda czy zimna? Znowu wszystko jest oczywiste – ten ciepły skończy pierwszy. Dlaczego wszystkie te dziwne pytania i doświadczenia? W celu określenia wielkości fizycznej zwanej „ilością ciepła”.
Ilość ciepła
Ilość ciepła to energia, którą organizm traci lub zyskuje podczas wymiany ciepła. Wynika to jasno z nazwy. Podczas chłodzenia ciało traci pewną ilość ciepła, a po podgrzaniu pochłania. A odpowiedzi na nasze pytania pokazały nam od czego zależy ilość ciepła? Po pierwsze, im większa masa ciała, tym więcej ciepła trzeba wydać, aby zmienić jego temperaturę o jeden stopień. Po drugie, ilość ciepła potrzebna do ogrzania ciała zależy od substancji, z której się składa, to znaczy od rodzaju substancji. I po trzecie, dla naszych obliczeń ważna jest również różnica temperatury ciała przed i po wymianie ciepła. Na podstawie powyższego możemy określ ilość ciepła według wzoru:
gdzie Q to ilość ciepła,
m - masa ciała,
(t_2-t_1) - różnica między początkową a końcową temperaturą ciała,
c - ciepło właściwe substancji, znajduje się w odpowiednich tabelach.
Korzystając z tego wzoru, możesz obliczyć ilość ciepła, która jest niezbędna do ogrzania dowolnego ciała lub jaką to ciało uwolni, gdy się ochłodzi.
Ilość ciepła jest mierzona w dżulach (1 J), jak każda inna forma energii. Jednak ta wartość została wprowadzona nie tak dawno temu, a ludzie zaczęli mierzyć ilość ciepła znacznie wcześniej. I użyli jednostki, która jest szeroko stosowana w naszych czasach - kalorii (1 cal). 1 kaloria to ilość ciepła potrzebna do podniesienia temperatury 1 grama wody o 1 stopień Celsjusza. Kierując się tymi danymi, miłośnicy liczenia kalorii w jedzeniu, które spożywają, mogą ze względu na zainteresowanie obliczyć, ile litrów wody można ugotować z energią, którą spożywają z jedzeniem w ciągu dnia.
730. Dlaczego do chłodzenia niektórych mechanizmów stosuje się wodę?
Woda ma świetne ciepło właściwe, co przyczynia się do dobrego odprowadzania ciepła z mechanizmu.
731. W jakim przypadku należy wydać więcej energii: na podgrzanie jednego litra wody o 1°C czy na podgrzanie stu gramów wody o 1°C?
Aby podgrzać litr wody, ponieważ im większa masa, tym więcej energii trzeba wydać.
732. Widelce z miedzioniklu i srebra o tej samej masie zanurzono w gorącej wodzie. Czy otrzymują taką samą ilość ciepła z wody?
Widelec z miedzioniklu otrzyma więcej ciepła, ponieważ ciepło właściwe miedzioniklu jest większe niż srebra.
733. Kawałek ołowiu i kawałek żeliwa o tej samej masie zostały trzykrotnie uderzone młotem kowalskim. Która część stała się gorętsza?
Ołów nagrzeje się bardziej, ponieważ jego ciepło właściwe jest mniejsze niż żeliwa, a do podgrzania ołowiu potrzeba mniej energii.
734. Jedna kolba zawiera wodę, druga zawiera naftę o tej samej masie i temperaturze. Do każdej kolby wrzucono równie podgrzaną żelazną kostkę. Co rozgrzeje się do wyższej temperatury - woda czy nafta?
Nafta oczyszczona.
735. Dlaczego wahania temperatury zimą i latem są mniej ostre w miastach nadmorskich niż w miastach położonych w głębi lądu?
Woda nagrzewa się i schładza wolniej niż powietrze. Zimą ochładza się i przenosi ciepłe masy powietrza na ląd, sprawiając, że klimat na wybrzeżu jest cieplejszy.
736. Ciepło właściwe aluminium to 920 J/kg °C. Co to znaczy?
Oznacza to, że do podgrzania 1 kg aluminium o 1°C potrzeba 920 J.
737. Pręty aluminiowe i miedziane o tej samej masie 1 kg schładza się o 1°C. Jak bardzo zmieni się energia wewnętrzna każdego bloku? Który pasek zmieni się bardziej io ile?
738. Jaka ilość ciepła jest potrzebna do podgrzania kilogramowego kęsa żelaza o 45 °C?
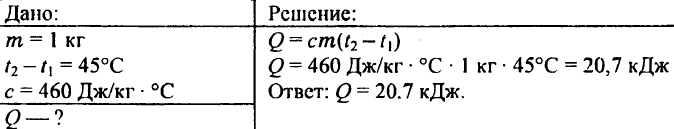
739. Ile ciepła potrzeba do podgrzania 0,25 kg wody z 30°C do 50°C?

740. Jak zmieni się energia wewnętrzna dwóch litrów wody po podgrzaniu o 5°C?

741. Ile ciepła potrzeba do podgrzania 5 g wody z 20 °C do 30 °C?

742. Jaka ilość ciepła jest potrzebna do podgrzania aluminiowej kuli o wadze 0,03 kg o 72 °C?

743. Oblicz ilość ciepła potrzebnego do podgrzania 15 kg miedzi o 80 °C.

744. Oblicz ilość ciepła potrzebnego do podgrzania 5 kg miedzi z 10 °C do 200 °C.
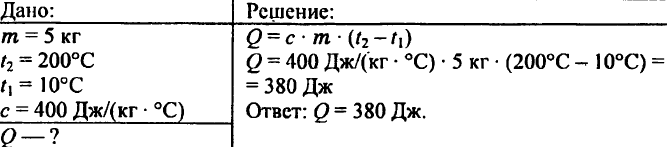
745. Jaka ilość ciepła jest potrzebna do podgrzania 0,2 kg wody z 15 °C do 20 °C?

746. Woda ważąca 0,3 kg ostygła o 20 °C. O ile zmniejsza się energia wewnętrzna wody?

747. Ile ciepła potrzeba do podgrzania 0,4 kg wody o temperaturze 20 °C do temperatury 30 °C?

748. Ile ciepła zużywa się na podgrzanie 2,5 kg wody o 20°C?
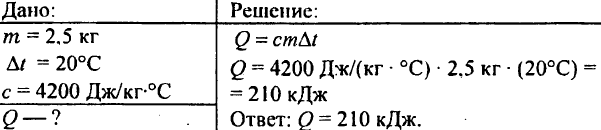
749. Ile ciepła zostało uwolnione, gdy 250 g wody schłodzono z 90 °C do 40 °C?

750. Jaka ilość ciepła jest potrzebna do podgrzania 0,015 litra wody o 1°C?

751. Obliczyć ilość ciepła potrzebnego do ogrzania stawu o objętości 300 m3 o 10 °C?

752. Ile ciepła należy oddać 1 kg wody, aby podnieść jej temperaturę z 30°C do 40°C?
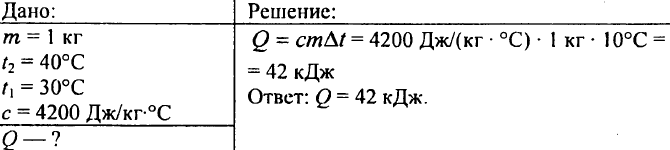
753. Woda o objętości 10 litrów ostygła z temperatury 100°C do temperatury 40°C. Ile ciepła uwalnia się w tym przypadku?

754. Oblicz ilość ciepła potrzebnego do podgrzania 1 m3 piasku o 60 °C.

755. Objętość powietrza 60 m3, ciepło właściwe 1000 J/kg °C, gęstość powietrza 1,29 kg/m3. Ile ciepła potrzeba, aby podnieść temperaturę do 22°C?

756. Woda została podgrzana do 10°C, wydając 4,20 103 J ciepła. Określ ilość wody.

757. Woda ważąca 0,5 kg wykazała 20,95 kJ ciepła. Jaka była temperatura wody, jeśli początkowa temperatura wody wynosiła 20°C?
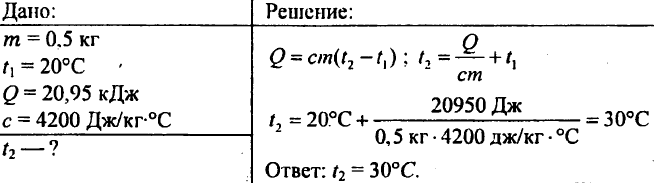
758,8 kg wody o temperaturze 10°C wlewa się do miedzianego rondla o wadze 2,5 kg. Ile ciepła potrzeba do zagotowania wody w rondlu?

759. Litr wody o temperaturze 15 °C wlewa się do miedzianej kadzi o wadze 300 g. Ile ciepła potrzeba do podgrzania wody w kadzi o 85 °C?

760. Kawałek rozgrzanego granitu o wadze 3 kg umieszcza się w wodzie. Granit przenosi 12,6 kJ ciepła do wody, schładzając ją o 10°C. Jaka jest właściwa pojemność cieplna kamienia?

761. Gorącą wodę o temperaturze 50°C dodano do 5 kg wody o temperaturze 12°C, otrzymując mieszaninę o temperaturze 30°C. Ile wody dodano?

762. Wodę o temperaturze 20°C dodano do 3 litrów wody o temperaturze 60°C w celu uzyskania wody o temperaturze 40°C. Ile wody dodano?

763. Jaka będzie temperatura mieszaniny, jeśli 600 g wody o temperaturze 80 °C zmieszać z 200 g wody o temperaturze 20 °C?

764. Litr wody o temperaturze 90°C wlano do wody o temperaturze 10°C i temperatura wody osiągnęła 60°C. Ile było zimna woda?

765. Określ, ile wlać do naczynia gorąca woda, podgrzany do 60 ° C, jeśli naczynie zawiera już 20 litrów zimnej wody o temperaturze 15 ° C; temperatura mieszaniny powinna wynosić 40 °C.

766. Określ, ile ciepła jest potrzebne do podgrzania 425 g wody o 20 °C.

767. Ile stopni ogrzeje 5 kg wody, jeśli woda otrzyma 167,2 kJ?

768. Ile ciepła potrzeba do podgrzania m gramów wody o temperaturze t1 do temperatury t2?
769. 2 kg wody wlewa się do kalorymetru o temperaturze 15 °C. Do jakiej temperatury nagrzeje się woda kalorymetru, jeśli włoży się do niej mosiężny odważnik o masie 500 g podgrzany do 100 °C? Ciepło właściwe mosiądzu wynosi 0,37 kJ/(kg °C).
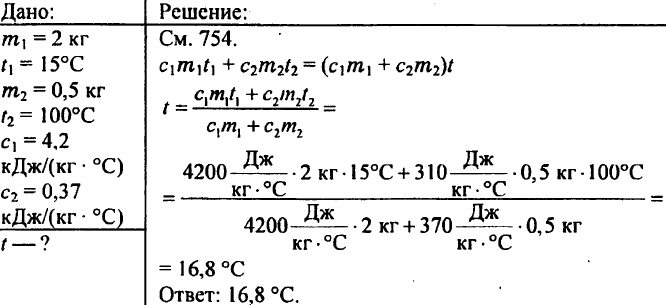
770. Są kawałki miedzi, cyny i aluminium o tej samej objętości. Który z tych kawałków ma największą, a który najmniejszą pojemność cieplną?

771. Do kalorymetru wlano 450 g wody o temperaturze 20°C. Gdy w tej wodzie zanurzono 200 g opiłków żelaza ogrzanych do 100°C, temperatura wody wzrosła do 24°C. Określ właściwą pojemność cieplną trocin.

772. Miedziany kalorymetr o wadze 100 g mieści 738 g wody o temperaturze 15 °C. Do tego kalorymetru wprowadzono 200 g miedzi w temperaturze 100°C, po czym temperatura kalorymetru wzrosła do 17°C. Jaka jest właściwa pojemność cieplna miedzi?

773. Stalową kulę o wadze 10 g wyjmuje się z pieca i zanurza w wodzie o temperaturze 10 °C. Temperatura wody wzrosła do 25°C. Jaka była temperatura kuli w piekarniku, jeśli masa wody wynosi 50 g? Ciepło właściwe stali wynosi 0,5 kJ/(kg °C).

777. 50 g wody o temperaturze 19 °C wlewa się do wody o wadze 150 g o temperaturze 35 °C. Jaka jest temperatura mieszanki?

778. Wodę o wadze 5 kg o temperaturze 90 °C wlano do żeliwnego czajnika o wadze 2 kg o temperaturze 10 °C. Jaka była temperatura wody?

779. Stalowe dłuto o wadze 2 kg zostało podgrzane do temperatury 800 °C, a następnie opuszczone do naczynia zawierającego 15 litrów wody o temperaturze 10 °C. Do jakiej temperatury zostanie podgrzana woda w naczyniu?

(Wskazanie. Aby rozwiązać ten problem, konieczne jest utworzenie równania, w którym pożądana temperatura wody w naczyniu po opuszczeniu noża jest przyjmowana jako niewiadoma.)
780. Jaką temperaturę osiągnie woda, jeśli zmieszasz 0,02 kg wody w 15 °C, 0,03 kg wody w 25 °C i 0,01 kg wody w 60 °C?

781. Ogrzewanie klasy dobrze wentylowanej wymaga ilości ciepła 4,19 MJ na godzinę. Woda wpływa do grzejników przy 80°C i wypływa przy 72°C. Ile wody należy co godzinę dostarczać do grzejników?

782. Ołów o masie 0,1 kg w temperaturze 100°C zanurzono w kalorymetrze aluminiowym o masie 0,04 kg zawierającym 0,24 kg wody o temperaturze 15°C. Następnie w kalorymetrze ustalono temperaturę 16°C. Jaka jest właściwa pojemność cieplna ołowiu?

Pojemność cieplna to ilość ciepła pochłoniętego przez ciało po podgrzaniu o 1 stopień.
Pojemność cieplna ciała jest oznaczona dużymi literami łacińska litera Z.
Od czego zależy pojemność cieplna ciała? Przede wszystkim z jego masy. Oczywiste jest, że podgrzanie np. 1 kilograma wody będzie wymagało więcej ciepła niż podgrzanie 200 gramów.
A co z rodzajem substancji? Zróbmy eksperyment. Weźmy dwa identyczne naczynia i wlewając do jednego z nich 400 g wody, a do drugiego olej roślinny o wadze 400 g, zaczniemy je podgrzewać za pomocą identycznych palników. Obserwując wskazania termometrów zobaczymy, że olej szybko się nagrzewa. Aby podgrzać wodę i olej do tej samej temperatury, woda musi być podgrzewana dłużej. Ale im dłużej podgrzewamy wodę, tym więcej ciepła otrzymuje z palnika.
Tak więc, aby podgrzać tę samą masę różnych substancji do tej samej temperatury, potrzebne są różne ilości ciepła. Ilość ciepła potrzebna do ogrzania ciała, a co za tym idzie, jego pojemność cieplna zależy od rodzaju substancji, z której to ciało się składa.
Na przykład, aby podnieść temperaturę wody o masie 1 kg o 1 ° C, wymagana jest ilość ciepła równa 4200 J, a do podgrzania tej samej masy oleju słonecznikowego o 1 ° C ilość wymagane jest ciepło równe 1700 J.
Fizyczną wielkość pokazującą, ile ciepła jest potrzebne do podgrzania 1 kg substancji o 1 ºС, nazywa się ciepło właściwe tę substancję.
Każda substancja ma własną pojemność cieplną właściwą, oznaczoną łacińską literą c i mierzoną w dżulach na kilogram-stopień (J / (kg ° C)).
Specyficzna pojemność cieplna tej samej substancji w różnych stanach skupienia (stałym, ciekłym i gazowym) jest różna. Na przykład ciepło właściwe wody wynosi 4200 J/(kg ºС), a ciepło właściwe lodu 2100 J/(kg ºС); aluminium w stanie stałym ma ciepło właściwe 920 J/(kg-°C), a w stanie ciekłym – 1080 J/(kg-°C).
Należy pamiętać, że woda ma bardzo wysoką pojemność cieplną. Dlatego podgrzewająca się latem woda w morzach i oceanach pochłania dużą ilość ciepła z powietrza. Z tego powodu w miejscach położonych w pobliżu dużych zbiorników wodnych lato nie jest tak gorące jak w miejscach oddalonych od wody.
Obliczanie ilości ciepła potrzebnego do ogrzania ciała lub uwolnionego przez nie podczas schładzania.
Z powyższego jasno wynika, że ilość ciepła potrzebna do ogrzania ciała zależy od rodzaju substancji, z której składa się ciało (tj. jego właściwej pojemności cieplnej) oraz od masy ciała. Oczywiste jest również, że ilość ciepła zależy od tego, o ile stopni zamierzamy podnieść temperaturę ciała.
Tak więc, aby określić ilość ciepła potrzebnego do ogrzania ciała lub uwolnionego przez nie podczas chłodzenia, należy pomnożyć ciepło właściwe ciała przez jego masę i różnicę między jego temperaturą końcową a początkową:
Q= cm (t 2 - t 1),
gdzie Q- ilość ciepła, c- specyficzna pojemność cieplna, m- masa ciała, t1- temperatura początkowa, t2- temperatura końcowa.
Kiedy ciało jest rozgrzane t2> t1 i stąd Q >0 . Kiedy ciało jest schłodzone t 2i< t1 i stąd Q< 0 .
Jeśli znamy pojemność cieplną całego ciała Z, Q określa wzór: Q \u003d C (t 2 - t1).
22) Topienie: definicja, obliczanie ilości ciepła do topnienia lub krzepnięcia, ciepło właściwe topnienia, wykres t 0 (Q).
Termodynamika
Dział fizyki molekularnej zajmujący się badaniem transferu energii, wzorców przekształcania niektórych rodzajów energii w inne. W przeciwieństwie do teorii kinetyki molekularnej termodynamika nie uwzględnia wewnętrznej struktury substancji i mikroparametrów.
Układ termodynamiczny
Jest to zbiór ciał, które wymieniają energię (w postaci pracy lub ciepła) ze sobą lub z środowisko. Np. woda w imbryku stygnie, następuje wymiana ciepła wody z imbrykiem i czajnika z otoczeniem. Cylinder z gazem pod tłokiem: tłok wykonuje pracę, w wyniku której gaz otrzymuje energię i zmieniają się jego parametry makro.
Ilość ciepła
To jest energia, która jest odbierana lub oddawana przez system w procesie wymiany ciepła. Oznaczony symbolem Q, mierzony, jak każda energia, w dżulach.
W wyniku różnych procesów wymiany ciepła przekazywana energia jest określana na swój sposób.
Ogrzewanie i chłodzenie
Proces ten charakteryzuje się zmianą temperatury układu. Ilość ciepła określa wzór

Ciepło właściwe substancji o mierzone ilością ciepła potrzebnego do podgrzania jednostki masy tej substancji o 1K. Podgrzanie 1 kg szkła lub 1 kg wody wymaga innej ilości energii. Ciepło właściwe to znana wartość już obliczona dla wszystkich substancji, patrz wartość w tabelach fizycznych.
Pojemność cieplna substancji C- jest to ilość ciepła, jaka jest potrzebna do ogrzania ciała bez uwzględniania jego masy o 1K.


Topienie i krystalizacja
Topienie to przejście substancji ze stanu stałego do stanu ciekłego. Odwrotne przejście nazywa się krystalizacją.
Energia poświęcona na zniszczenie sieci krystalicznej substancji, określa wzór


Ciepło właściwe wartość topnienia znana dla każdej substancji, patrz wartość w tabelach fizycznych.
Odparowanie (odparowanie lub gotowanie) i kondensacja
Waporyzacja to przejście substancji ze stanu ciekłego (stałego) do stanu gazowego. Proces odwrotny nazywa się kondensacją.


Ciepło właściwe parowania jest wartością znaną dla każdej substancji, patrz wartości w tabelach fizycznych.
Spalanie
Ilość ciepła uwalnianego podczas spalania substancji


Ciepło właściwe spalania jest wartością znaną dla każdej substancji, patrz wartość w tabelach fizycznych.
Dla zamkniętego i izolowanego adiabatycznie układu ciał spełnione jest równanie bilansu cieplnego. Suma algebraiczna ilości ciepła oddanego i odebranego przez wszystkie ciała uczestniczące w wymianie ciepła jest równa zeru:
Q 1 +Q 2 +...+Q n =0
23) Struktura cieczy. warstwa powierzchniowa. Siła napięcia powierzchniowego: przykłady manifestacji, obliczenia, współczynnik napięcia powierzchniowego.
Od czasu do czasu dowolna cząsteczka może przenieść się do sąsiedniego wakatu. Takie skoki w cieczach zdarzają się dość często; dlatego cząsteczki nie są związane z pewnymi centrami, jak w kryształach, i mogą poruszać się w całej objętości cieczy. To wyjaśnia płynność płynów. Ze względu na silne oddziaływanie między blisko oddalonymi cząsteczkami mogą one tworzyć lokalne (niestabilne) uporządkowane grupy zawierające kilka cząsteczek. Zjawisko to nazywa się zamówienie bliskiego zasięgu(Rys. 3.5.1).
Współczynnik β nazywa się współczynnik temperaturowy rozszerzalności objętości . Ten współczynnik dla cieczy jest dziesięciokrotnie większy niż dla ciał stałych. Dla wody, na przykład w temperaturze 20 ° C, β w 2 10 - 4 K - 1, dla stali β st ≈ 3,6 10 - 5 K - 1, dla szkła kwarcowego β kv ≈ 9 10 - 6 K - jeden .
Rozszerzalność termiczna wody ma interesującą i ważną anomalię dla życia na Ziemi. W temperaturze poniżej 4 °C woda rozszerza się wraz ze spadkiem temperatury (β< 0). Максимум плотности ρ в = 10 3 кг/м 3 вода имеет при температуре 4 °С.
Gdy woda zamarza, rozszerza się, więc lód nadal unosi się na powierzchni zamarzającej wody. Temperatura zamarzającej wody pod lodem wynosi 0°C. W gęstszych warstwach wody w pobliżu dna zbiornika temperatura wynosi około 4 °C. Dzięki temu w wodzie zbiorników zamarzających może istnieć życie.
Bardzo ciekawa funkcja płyny to obecność Wolna powierzchnia . Ciecz, w przeciwieństwie do gazów, nie wypełnia całej objętości naczynia, do którego jest wlewana. Pomiędzy cieczą i gazem (lub parą) tworzy się granica faz, która znajduje się w specjalnych warunkach w porównaniu z resztą masy cieczy.Należy pamiętać, że ze względu na wyjątkowo niską ściśliwość, obecność gęstszego upakowana warstwa wierzchnia nie powoduje zauważalnej zmiany objętości cieczy. Jeśli cząsteczka przemieści się z powierzchni do cieczy, siły oddziaływania międzycząsteczkowego wykonają pozytywną pracę. Wręcz przeciwnie, aby wyciągnąć określoną liczbę cząsteczek z głębokości cieczy na powierzchnię (czyli zwiększyć powierzchnię cieczy), siły zewnętrzne muszą wykonać pozytywną pracę Δ A zewnętrzne proporcjonalne do zmiany Δ S powierzchnia:
Z mechaniki wiadomo, że stany równowagi układu odpowiadają minimalnej wartości jego energii potencjalnej. Wynika z tego, że wolna powierzchnia cieczy ma tendencję do zmniejszania swojej powierzchni. Z tego powodu swobodna kropla cieczy przybiera kulisty kształt. Płyn zachowuje się tak, jakby siły działały stycznie do jego powierzchni, zmniejszając (kurcząc) tę powierzchnię. Te siły nazywają się siły napięcia powierzchniowego .
Obecność sił napięcia powierzchniowego sprawia, że powierzchnia cieczy wygląda jak elastycznie rozciągnięta folia, z tą różnicą, że siły sprężystości w folii zależą od jej pola powierzchni (tj. od sposobu deformacji folii) i sił napięcia powierzchniowego nie zależą na powierzchni cieczy.
Niektóre płyny, takie jak woda z mydłem, mają zdolność tworzenia cienkich warstw. Wszystkie znane nam bańki mydlane mają prawidłowy kulisty kształt – to również świadczy o działaniu sił napięcia powierzchniowego. Jeśli ramka druciana zostanie opuszczona do roztworu mydła, którego jeden z boków jest ruchomy, wówczas całość zostanie pokryta warstwą płynu (ryc. 3.5.3).
Siły napięcia powierzchniowego mają tendencję do skracania powierzchni folii. Aby zrównoważyć ruchomą stronę ramy, należy przyłożyć do niej siłę zewnętrzną.Jeżeli pod działaniem siły poprzeczka przesuwa się o Δ x, to praca Δ A wew = F wew x = Δ Ep = σΔ S, gdzie ∆ S = 2LΔ x to przyrost pola powierzchni po obu stronach filmu mydlanego. Ponieważ moduły sił i są takie same, możemy napisać:
|
Zatem współczynnik napięcia powierzchniowego σ można zdefiniować jako moduł siły napięcia powierzchniowego działającej na jednostkę długości linii ograniczającej powierzchnię.
W wyniku działania sił napięcia powierzchniowego w kropelkach cieczy i wewnątrz bańki mydlane występuje nadciśnienie Δ p. Jeśli mentalnie wytniemy sferyczną kroplę o promieniu R na dwie połówki, to każda z nich musi być w równowadze pod działaniem sił napięcia powierzchniowego przyłożonych do granicy przecięcia o długości 2π R i siła nadciśnienie działając na powierzchnię π R 2 sekcje (rys. 3.5.4). Warunek równowagi jest zapisany jako
Jeżeli siły te są większe niż siły oddziaływania między cząsteczkami samej cieczy, to ciecz mokry powierzchnia ciała stałego. W tym przypadku ciecz zbliża się do powierzchni ciała stałego pod pewnym kątem ostrym θ, charakterystycznym dla danej pary ciecz-ciało stałe. Kąt θ nazywa się kąt kontaktu . Jeżeli siły oddziaływania między cząsteczkami cieczy przekraczają siły ich oddziaływania z cząsteczkami stałymi, to kąt zwilżania θ okazuje się rozwarty (ryc. 3.5.5). W tym przypadku mówi się, że płyn nie moknie powierzchnia ciała stałego. Na całkowite zwilżenieθ = 0, w całkowity brak zwilżaniaθ = 180°.
zjawiska kapilarne zwany wznoszeniem lub opadaniem płynu w rurkach o małej średnicy - kapilary. Ciecze zwilżające wznoszą się przez naczynia włosowate, ciecze niezwilżające opadają.
Na ryc. 3.5.6 przedstawia rurkę kapilarną o określonym promieniu r opuszczony przez dolny koniec do cieczy zwilżającej o gęstości ρ. Górny koniec kapilary jest otwarty. Wzrost cieczy w kapilarze trwa do momentu, gdy siła grawitacji działająca na słup cieczy w kapilarze stanie się równa w wartości bezwzględnej wynikowej F n siły napięcia powierzchniowego działające wzdłuż granicy kontaktu cieczy z powierzchnią kapilary: F t = F n, gdzie F t = mg = ρ hπ r 2 g, F n = σ2π r cos .
Oznacza to:
Przy całkowitym niezwilżaniu θ = 180°, cos θ = –1, a zatem h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Woda prawie całkowicie zwilża czystą szklaną powierzchnię. I odwrotnie, rtęć nie zwilża całkowicie powierzchni szkła. Dlatego poziom rtęci w szklanej kapilarze spada poniżej poziomu w naczyniu.
24) Waporyzacja: definicja, rodzaje (parowanie, gotowanie), obliczanie ilości ciepła parowania i kondensacji, ciepło właściwe parowania.
Parowanie i kondensacja. Wyjaśnienie zjawiska parowania na podstawie idei budowy molekularnej materii. Ciepło właściwe parowania. Jej jednostki.
Zjawisko zamieniania się cieczy w parę nazywa się odparowanie.
Odparowanie - proces waporyzacji zachodzący z otwartej powierzchni.
Cząsteczki cieczy poruszają się z różnymi prędkościami. Jeśli jakakolwiek cząsteczka znajduje się na powierzchni cieczy, może przezwyciężyć przyciąganie sąsiednich cząsteczek i wylecieć z cieczy. Uciekające cząsteczki tworzą parę. Prędkości pozostałych cząsteczek cieczy zmieniają się po zderzeniu. W tym przypadku niektóre molekuły uzyskują prędkość wystarczającą, aby wylecieć z cieczy. Proces ten trwa, więc płyny powoli odparowują.
*Szybkość parowania zależy od rodzaju cieczy. Ciecze te szybciej odparowują, przy czym cząsteczki są przyciągane z mniejszą siłą.
*Parowanie może nastąpić w dowolnej temperaturze. Ale w wyższych temperaturach parowanie jest szybsze .
*Szybkość parowania zależy od jego powierzchni.
*W przypadku wiatru (przepływ powietrza) parowanie następuje szybciej.
Podczas parowania zmniejsza się energia wewnętrzna, ponieważ. podczas parowania szybkie cząsteczki opuszczają ciecz, dlatego średnia prędkość pozostałych cząsteczek maleje. Oznacza to, że jeśli nie ma dopływu energii z zewnątrz, to temperatura cieczy spada.
 Nazywa się zjawisko przemiany pary w ciecz kondensacja.
Towarzyszy temu uwalnianie energii.
Nazywa się zjawisko przemiany pary w ciecz kondensacja.
Towarzyszy temu uwalnianie energii.
Kondensacja pary wyjaśnia powstawanie chmur. Para wodna unosząca się nad ziemią tworzy chmury w górnych, zimnych warstwach powietrza, które składają się z maleńkich kropel wody.
Ciepło właściwe waporyzacji - fizyczny. ilość wskazująca, ile ciepła jest potrzebne do przekształcenia cieczy o masie 1 kg w parę bez zmiany temperatury.
Oud. ciepło parowania oznaczony literą L i mierzony w J / kg
Oud. ciepło parowania wody: L=2,3×106 J/kg, alkohol L=0,9×106
Ilość ciepła potrzebna do przekształcenia cieczy w parę: Q = Lm
Energia wewnętrzna ciała może się zmieniać pod wpływem działania sił zewnętrznych. Aby scharakteryzować zmianę energii wewnętrznej podczas wymiany ciepła, wprowadza się wielkość zwaną ilością ciepła i oznaczaną przez Q.
W systemie międzynarodowym jednostką ilości ciepła oraz pracy i energii jest dżul: = = = 1 J.
W praktyce czasami stosuje się pozasystemową jednostkę ilości ciepła - kalorię. 1 cal. = 4,2 J.
Należy zauważyć, że określenie „ilość ciepła” jest niefortunne. Został wprowadzony w czasie, gdy wierzono, że ciała zawierają jakąś nieważką, nieuchwytną ciecz - kaloryczną. Proces wymiany ciepła rzekomo polega na tym, że kaloryczność, przelewając się z jednego ciała do drugiego, niesie ze sobą pewną ilość ciepła. Teraz, znając podstawy molekularno-kinetycznej teorii budowy materii, rozumiemy, że w ciałach nie ma kalorii, mechanizm zmiany energii wewnętrznej ciała jest inny. Jednak siła tradycji jest ogromna i nadal używamy terminu, wprowadzonego na podstawie błędnych wyobrażeń o naturze ciepła. Jednocześnie, rozumiejąc naturę wymiany ciepła, nie należy całkowicie ignorować błędnych przekonań na ten temat. Wręcz przeciwnie, kreśląc analogię między przepływem ciepła a przepływem hipotetycznego płynu kalorycznego, ilością ciepła i ilością kaloryczną, możliwe jest, przy rozwiązywaniu niektórych klas problemów, wizualizację zachodzących procesów i poprawnie rozwiązywać problemy. Ostatecznie poprawne równania opisujące procesy wymiany ciepła zostały uzyskane w pewnym momencie na podstawie błędnych wyobrażeń o kaloryczności jako nośniku ciepła.
Rozważmy bardziej szczegółowo procesy, które mogą wystąpić w wyniku wymiany ciepła.
Wlej trochę wody do probówki i zamknij korkiem. Probówkę zawiesić na pręcie zamocowanym w trójnogu i podłożyć pod nią otwarty płomień. Z płomienia probówka otrzymuje pewną ilość ciepła i podnosi się temperatura znajdującej się w niej cieczy. Wraz ze wzrostem temperatury wzrasta energia wewnętrzna cieczy. Następuje intensywny proces jej waporyzacji. Rozprężające się opary cieczy wykonują pracę mechaniczną, aby wypchnąć korek z tuby.
Przeprowadźmy kolejny eksperyment z modelem armaty wykonanym z kawałka mosiężnej rury, która jest zamontowana na wózku. Z jednej strony rurka jest szczelnie zamknięta ebonitową zatyczką, przez którą przechodzi szpilka. Do kołka i rurki przylutowane są przewody, zakończone zaciskami, które mogą być zasilane z sieci oświetleniowej. Model pistoletu jest więc rodzajem kotła elektrycznego.
 |
Wlej trochę wody do lufy armaty i zamknij rurkę gumowym korkiem. Podłącz pistolet do źródła zasilania. Przepływający przez wodę prąd elektryczny podgrzewa ją. Woda wrze, co prowadzi do jej intensywnego parowania. Ciśnienie pary wodnej wzrasta iw końcu wykonują pracę polegającą na wypchnięciu korka z lufy pistoletu.
Pistolet w wyniku odrzutu cofa się w kierunku przeciwnym do wyrzutni korkowej.
Oba doświadczenia łączą następujące okoliczności. Podczas podgrzewania płynu różne sposoby, temperatura cieczy i odpowiednio jej energia wewnętrzna wzrosły. Aby ciecz intensywnie się zagotowała i odparowała, konieczne było dalsze jej podgrzewanie.
Pary cieczy, ze względu na swoją energię wewnętrzną, wykonywały pracę mechaniczną.
 |
Badamy zależność ilości ciepła potrzebnego do ogrzania ciała od jego masy, zmian temperatury i rodzaju substancji. Do badania tych zależności użyjemy wody i oleju. (Do pomiaru temperatury w eksperymencie używany jest termometr elektryczny, wykonany z termopary połączonej z galwanometrem lustrzanym. Jedno złącze termopary jest opuszczane do naczynia z zimną wodą, aby zapewnić stałą temperaturę. Drugie złącze termopary mierzy temperaturę badanej cieczy).
Doświadczenie składa się z trzech serii. W pierwszej serii dla stałej masy danej cieczy (w naszym przypadku wody) badana jest zależność ilości ciepła potrzebnego do jej podgrzania od zmiany temperatury. Ocenimy ilość ciepła odbieranego przez ciecz z grzałki (kuchenki elektrycznej) przez czas nagrzewania, zakładając, że istnieje między nimi bezpośrednia zależność. zależność proporcjonalna. Aby wynik eksperymentu odpowiadał temu założeniu, konieczne jest zapewnienie stałego przepływu ciepła z kuchenki elektrycznej do ogrzewanego korpusu. Aby to zrobić, kuchenka elektryczna została wcześniej podłączona do sieci, aby na początku eksperymentu temperatura jej powierzchni przestała się zmieniać. Aby uzyskać bardziej równomierne nagrzewanie cieczy podczas eksperymentu, wymieszamy ją za pomocą samej termopary. Odczyty termometru będziemy rejestrować w regularnych odstępach czasu, aż plamka światła dotrze do krawędzi skali.
Załóżmy, że istnieje bezpośrednia proporcjonalna zależność między ilością ciepła potrzebnego do ogrzania ciała a zmianą jego temperatury.
W drugiej serii eksperymentów porównamy ilość ciepła potrzebną do podgrzania tych samych cieczy o różnych masach, gdy ich temperatura zmieni się o tę samą wartość.
Dla wygody porównywania otrzymanych wartości masa wody do drugiego eksperymentu zostanie pobrana dwa razy mniej niż w pierwszym eksperymencie.
Ponownie będziemy rejestrować odczyty termometru w regularnych odstępach czasu.
Porównując wyniki pierwszego i drugiego eksperymentu, możemy wyciągnąć następujące wnioski.
W trzeciej serii eksperymentów porównamy ilości ciepła potrzebne do podgrzania równych mas różnych cieczy, gdy ich temperatura zmieni się o tę samą wartość.
Podgrzejemy olej na kuchence elektrycznej, której masa w pierwszym eksperymencie jest równa masie wody. Odczyty termometru będziemy rejestrować w regularnych odstępach czasu.
Wynik eksperymentu potwierdza wniosek, że ilość ciepła niezbędna do ogrzania ciała jest wprost proporcjonalna do zmiany jego temperatury, a ponadto wskazuje na zależność tej ilości ciepła od rodzaju substancji.
Ponieważ w eksperymencie użyto oleju, którego gęstość jest mniejsza od gęstości wody, a do podgrzania oleju do określonej temperatury potrzebna była mniejsza ilość ciepła niż do podgrzania wody, można przyjąć, że ilość ciepła potrzebna do ogrzania ciała zależy od jego gęstości.
Aby przetestować to założenie, będziemy jednocześnie podgrzewać identyczne masy wody, parafiny i miedzi na grzałce o stałej mocy.
W tym samym czasie temperatura miedzi jest około 10 razy, a parafiny około 2 razy wyższa niż temperatura wody.
Ale miedź ma większą gęstość i mniejszą parafinę niż woda.
Doświadczenie pokazuje, że wielkością charakteryzującą szybkość zmian temperatury substancji, z których zbudowane są ciała uczestniczące w wymianie ciepła, nie jest gęstość. Ta wielkość nazywana jest właściwą pojemnością cieplną substancji i jest oznaczona literą c.
 |
Do porównywania pojemności cieplnych właściwych różnych substancji służy specjalne urządzenie. Urządzenie składa się ze stojaków, w których zamocowana jest cienka płyta parafinowa oraz pręt z przepuszczonymi przez nią prętami. Na końcach prętów zamocowane są cylindry aluminiowe, stalowe i mosiężne o jednakowej masie.
Butle podgrzewamy do tej samej temperatury zanurzając je w naczyniu z wodą stojącym na rozgrzanej kuchence elektrycznej. Zamocujmy gorące butle na stojakach i zwolnijmy je z łączników. Cylindry jednocześnie dotykają płytki parafinowej i topiąc parafinę zaczynają się w niej zapadać. Głębokość zanurzenia cylindrów o tej samej masie w płytkę parafinową, gdy ich temperatura zmienia się o tę samą wartość, okazuje się inna.
Doświadczenie pokazuje, że właściwe pojemności cieplne aluminium, stali i mosiądzu są różne.
Po wykonaniu odpowiednich eksperymentów z topieniem ciał stałych, parowaniem cieczy i spalaniem paliwa otrzymujemy następujące zależności ilościowe.
Aby uzyskać jednostki o określonych ilościach, należy je wyrazić z odpowiednich wzorów, a do otrzymanych wyrażeń należy podstawić jednostki ciepła - 1 J, masy - 1 kg, a dla ciepła właściwego - i 1 K.
Otrzymujemy jednostki: ciepło właściwe - 1 J/kg K, pozostałe ciepło właściwe: 1 J/kg.
Proces przenoszenia energii z jednego ciała do drugiego bez wykonywania pracy nazywa się wymiana ciepła lub wymiana ciepła. Przenoszenie ciepła zachodzi między ciałami o różnych temperaturach. Kiedy dochodzi do kontaktu między ciałami o różnych temperaturach, część energii wewnętrznej jest przekazywana z ciała o wyższej temperaturze do ciała o niższej temperaturze. Energia przekazana organizmowi w wyniku wymiany ciepła nazywa się ilość ciepła.
Ciepło właściwe substancji:
Jeżeli procesowi wymiany ciepła nie towarzyszy praca, to zgodnie z pierwszą zasadą termodynamiki ilość ciepła jest równa zmianie energii wewnętrznej ciała: .
Średnia energia losowego ruchu translacyjnego cząsteczek jest proporcjonalna do temperatury bezwzględnej. Zmiana energii wewnętrznej ciała jest równa sumie algebraicznej zmian energii wszystkich atomów lub cząsteczek, których liczba jest proporcjonalna do masy ciała, a więc zmiana energii wewnętrznej, a co za tym idzie, ilość ciepła jest proporcjonalna do zmiany masy i temperatury:


Współczynnik proporcjonalności w tym równaniu nazywa się ciepło właściwe substancji. Ciepło właściwe wskazuje, ile ciepła jest potrzebne do podniesienia temperatury 1 kg substancji o 1 K.
Praca w termodynamice:
W mechanice pracę definiuje się jako iloczyn modułów siły i przemieszczenia oraz cosinusa kąta między nimi. Praca jest wykonywana, gdy siła działa na poruszające się ciało i jest równa zmianie jego energii kinetycznej.
W termodynamice nie bierze się pod uwagę ruchu ciała jako całości, mówimy o ruchu części ciała makroskopowego względem siebie. W rezultacie zmienia się objętość ciała, a jego prędkość pozostaje równa zeru. Praca w termodynamice definiowana jest tak samo jak w mechanice, ale jest to zmiana nie energii kinetycznej ciała, ale jego energii wewnętrznej.
Po zakończeniu pracy (sprężanie lub rozprężanie) zmienia się energia wewnętrzna gazu. Powód tego jest następujący: podczas zderzeń sprężystych cząsteczek gazu z poruszającym się tłokiem zmienia się ich energia kinetyczna.
Obliczmy pracę gazu podczas ekspansji. Gaz działa na tłok z siłą  , gdzie
, gdzie  to ciśnienie gazu, i
to ciśnienie gazu, i  - powierzchnia
- powierzchnia  tłok. W miarę rozszerzania się gazu tłok porusza się w kierunku siły
tłok. W miarę rozszerzania się gazu tłok porusza się w kierunku siły  na krótki dystans
na krótki dystans  . Jeśli odległość jest niewielka, ciśnienie gazu można uznać za stałe. Praca gazu to:
. Jeśli odległość jest niewielka, ciśnienie gazu można uznać za stałe. Praca gazu to:
Gdzie  - zmiana objętości gazu.
- zmiana objętości gazu.
W procesie rozprężania gazu wykonuje pozytywną pracę, ponieważ kierunek siły i przemieszczenia pokrywają się. W procesie ekspansji gaz oddaje energię do otaczających ciał.
Praca wykonywana przez ciała zewnętrzne na gazie różni się od pracy gazu tylko znakiem  , bo siła
, bo siła  działanie na gaz jest przeciwne do siły
działanie na gaz jest przeciwne do siły  , z którym gaz działa na tłok i jest mu równy w wartości bezwzględnej (trzecie prawo Newtona); a ruch pozostaje ten sam. Dlatego praca sił zewnętrznych jest równa:
, z którym gaz działa na tłok i jest mu równy w wartości bezwzględnej (trzecie prawo Newtona); a ruch pozostaje ten sam. Dlatego praca sił zewnętrznych jest równa:
 .
.
Pierwsza zasada termodynamiki:
Pierwszą zasadą termodynamiki jest zasada zachowania energii, rozszerzona na zjawiska cieplne. Prawo zachowania energii: energia w naturze nie powstaje z niczego i nie znika: ilość energii pozostaje niezmienna, zmienia się tylko z jednej formy w drugą.
W termodynamice brane są pod uwagę ciała, których położenie środka ciężkości praktycznie się nie zmienia. Energia mechaniczna takich ciał pozostaje stała, a zmieniać się może tylko energia wewnętrzna.
Energię wewnętrzną można zmienić na dwa sposoby: przenoszenie ciepła i pracę. W ogólnym przypadku energia wewnętrzna zmienia się zarówno z powodu wymiany ciepła, jak i wykonywania pracy. Pierwsza zasada termodynamiki jest sformułowana właśnie dla takich ogólnych przypadków:
Zmiana energii wewnętrznej układu podczas jego przejścia z jednego stanu do drugiego jest równa sumie pracy sił zewnętrznych i ilości ciepła przekazanego do układu:

Jeśli system jest izolowany, to nie wykonuje się na nim żadnej pracy i nie wymienia ciepła z otaczającymi ciałami. Zgodnie z pierwszą zasadą termodynamiki energia wewnętrzna systemu izolowanego pozostaje niezmieniona.
Jeśli się uwzględni  , pierwszą zasadę termodynamiki można zapisać w następujący sposób:
, pierwszą zasadę termodynamiki można zapisać w następujący sposób:

Ilość ciepła przekazanego do systemu idzie na zmianę jego energii wewnętrznej i wykonanie przez system pracy na ciałach zewnętrznych.
Druga zasada termodynamiki: niemożliwe jest przeniesienie ciepła z chłodniejszego systemu do cieplejszego przy braku innych jednoczesnych zmian w obu systemach lub w otaczających ciałach.
