Cel
Opanowanie i utrwalenie materiału teoretycznego na temat kursu termodynamiki „Para wodna”, a także opanowanie metod eksperymentalnych i przetwarzanie uzyskanych danych, zapoznanie się z tabelami „Właściwości termofizyczne wody i pary wodnej”.
1. Przeanalizuj schemat instalacji eksperymentalnej, włącz ją i doprowadź do danego stacjonarnego reżimu termicznego.
2. Przeprowadź doświadczenie zgodnie z instrukcją metodyczną, wypełnij tabelę 1.
3. Wyznacz ciepło właściwe wydane na odparowanie wody w doświadczeniu.
4. Dla izobarycznego procesu odparowywania należy wyznaczyć tabelaryczne wartości parametrów wody na linii nasycenia i suchej pary nasyconej oraz ciepło właściwe parowania.
5. Oblicz energię wewnętrzną cieczy na linii nasycenia parą dla warunków doświadczalnych.
6. Oblicz błąd znalezionej wartości ciepło właściwe parowanie w stosunku do stołu.
7. Przedstaw procesy zachodzące w naczyniu Dewara na wykresach P-v i T-s.
8. Wyciągnij wnioski na temat pracy.
INSTRUKCJE METODOLOGICZNE
Przejście substancji ze stanu ciekłego do stanu gazowego nazywa się parowaniem, a przejście odwrotne nazywa się kondensacją. Wrzenie cieczy to proces parowania wewnątrz cieczy, który zachodzi w ściśle określonej temperaturze t n, °C, wyznaczanej ciśnieniem. Jeżeli faza gazowa występuje z fazą ciekłą tej samej substancji, wówczas nazywa się ją parą. Fazą gazową układu jest sucha para nasycona, fazą ciekłą jest ciecz utrzymująca stan odpowiadający początkowi parowania.
Podczas waporyzacji w procesie izobaryczno-izotermicznym, zgodnie z pierwszą zasadą termodynamiki, ciepło właściwe przemiany fazowej (ciepło właściwe parowania) r, J/kg,
r = u" - u" + p (v" -v"), (1)
r = ja" - ja" , (2)
gdzie ty”, ja”, v” - odpowiednio, energię wewnętrzną, entalpię, J/kg i objętość właściwą suchej pary nasyconej, m 3 /kg;
u", i", v" - odpowiednio energia wewnętrzna, entalpia, J/kg i objętość właściwa cieczy w stanie nasycenia, m 3 /kg.
Ciśnienie p, Pa nie jest oznaczone specjalnymi wskaźnikami, ponieważ nie zmienia się podczas całego przejścia fazowego i jest równe ciśnieniu nasycenia.
Zatem ciepło właściwe parowania obejmuje zmianę energii wewnętrznej substancji i pracę zmiany objętości podczas przejścia fazowego.
Ciepło właściwe parowania jest funkcjonalnie powiązane z parametrami stanu. Dla większości substancji stosowanych w praktyce określa się i zestawia w tabeli właściwości cieczy i pary na linii nasycenia. Tabele te pokazują wartości p i t na linii nasycenia oraz odpowiadające im wartości wielkości v”, v”, i”, i”, r, s”, s”. Energia wewnętrzna cieczy na linii nasycenia u", J/kg i suchej pary nasyconej u", J/kg, zostanie odpowiednio wyznaczona z równań
u" = i" -pv" (3)
u" = i" -pv" (4)
ZESTAW DOŚWIADCZALNY
Rysunek. Schemat konfiguracji eksperymentalnej
Układ doświadczalny (rysunek) składa się z kolby Dewara 1 z grzałką elektryczną 2, do której wlewa się część wody destylowanej ze zbiornika 3, sterowanej zaworem 4. Powstała para w skraplaczu 5, przez którą przepływa woda wodociągowa, zamienia się w w płyn. Przepływ wody reguluje zawór 7 zgodnie z lampką kontrolną 8. Powstały kondensat zbiera się w cylindrze pomiarowym 9. Na panelu sterowania znajdują się: przełącznik „SIEĆ” 10, woltomierz 11, amperomierz 12, przełącznik trybu 13; 6 - lejek szklany.
METODOLOGIA EKSPERYMENTALNA
1. Włącz instalację ustawiając przełącznik 10 w pozycję „1”.
2. Sprawdź napełnienie naczynia Dewara 1, ustawiając przełącznik trybu 13 w pozycji „NAPEŁNIANIE”. Jeśli zaświeci się zielona lampka sygnalizacyjna „Naczynie jest pełne”, możesz rozpocząć eksperyment. W przeciwnym wypadku naczynie napełnia się wodą destylowaną, dla czego otwiera się zawór 4. Po zaświeceniu się zielonej lampki sygnalizacyjnej należy szczelnie zamknąć naczynie.
3. Ustaw przełącznik 13 w pozycji „OGRZEWANIE”.
4. Obracając pokrętłem autotransformatora 14, ustawić zadaną przez nauczyciela wartość napięcia na grzałce U, V (oraz prądu I, A).
5. Doprowadzić wodę chłodzącą do skraplacza 5, otwierając zawór 7 i wyregulować przepływ wody zgodnie z lampką kontrolną 8.
6. Ustalając stacjonarny tryb wrzenia wody w naczyniu Dewara (w cylindrze miarowym nr 9 zbierze się 15-20 cm kondensatu), należy przeprowadzić kontrolny zbiór kondensatu w ilości określonej przez nauczyciela (V, m 3) . Czas trwania zbioru kontrolnego t, s określa się za pomocą stopera.
7. Za pomocą barometru określ ciśnienie atmosferyczne Pa, mmHg.
8. Dane pomiarowe wpisz do tabeli obserwacyjnej i poproś o podpis nauczyciela.
9. Włącz instalację przekręcając przełącznik „0”, zamknij zawór 7, przekręć uchwyt autotransformatora w kierunku przeciwnym do ruchu wskazówek zegara do oporu, spuść kondensat do pojemnika 3.
Tabela 1
|
Numer pomiaru |
mm. rt. Sztuka. | ||||
PRZETWARZANIE DANYCH EKSPERYMENTALNYCH
1. Oblicz ilość ciepła wydatkowanego na odparowanie 1 kg wody r op, J/kg:
r op = (W - Q) / (Vr),
gdzie W = UI - moc grzałki, W;
Q = 0,04 W - straty ciepła, W;
r - gęstość kondensatu, kg/m3. Przyjmujemy r = 1000 kg/m3.
2. Zakładając, że woda wrze pod ciśnieniem atmosferycznym, określ tabelaryczne wartości parametrów wody na linii nasycenia i suchej pary nasyconej, które wpisuje się w tabeli 2.
Tabela 2
|
i”, kJ/kg |
S", kJ/(kgK) |
i”, kJ/kg |
S", J/(kgK) | |||
3. Oblicz wartości energii wewnętrznej wody na linii nasycenia u" i suchej pary nasyconej u", kJ/kg, korzystając ze wzorów (3) i (4).
4. Obliczyć błąd w % znalezionej wartości ciepła właściwego parowania r op, kJ/kg, w odniesieniu do tabelarycznego r, kJ/kg, korzystając ze wzoru:
re = (r op - r) 100 / r.
5. Przedstaw graficznie procesy zachodzące w naczyniu Dewara na wykresach P-v i T-s.
6. Wyciągnij wnioski na temat pracy.
PYTANIA DO SAMODZIELNEGO PRZYGOTOWANIA
1. Odparowanie cieczy; istota procesów wrzenia i parowania cieczy.
2. Izobaryczny proces przejścia cieczy w parę przegrzaną na wykresach P-v i T-s.
3. Krzywe graniczne ze stopniem suchości x = 0 i x = 1, stan krytyczny substancji
4. Pojęcia: ciecz na linii nasycenia, para nasycona mokra, para nasycona sucha, para przegrzana.
5. Ciepło właściwe parowania cieczy.
6. Stopień suchości, stopień wilgotności pary.
7. Tablice właściwości termofizycznych wody i pary wodnej, ich znaczenie.
8. Wyznaczanie parametrów pary mokrej.
9. Diagram i-s pary wodnej, jego przeznaczenie.
10. Procesy termodynamiczne pary na diagramach P-v, T-s, i-s.
LISTA BIBLIOGRAFICZNA
1. Inżynieria cieplna / wyd. A.P. Baskakova - M.: Energoizdat, 1991. - 224 s.
2. Nashchokin V.V. Termodynamika techniczna i wymiana ciepła.- M.:: Szkoła Podyplomowa, 1980. - 496 s.
3. Yudaev B.N. Termodynamika techniczna. Przenikanie ciepła - M.: Szkoła Wyższa, 1998. - 480 s.
4. Rivkin S.L., Aleksandrov A.A. Tablice właściwości termofizycznych wody i pary wodnej - M.: Energy, 1980. - 408 s.
Czy wiesz, jaka jest temperatura wrzenia zupy? 100˚С. Nie więcej nie mniej. W tej samej temperaturze w czajniku gotuje się makaron. Co to znaczy?
Dlaczego jest tak, że gdy rondelek lub czajnik jest stale podgrzewany palącym się gazem, temperatura wody w nim nie wzrasta powyżej stu stopni? Faktem jest, że gdy woda osiągnie temperaturę stu stopni, cała przychodząca energia cieplna jest wydawana na przejście wody w stan gazowy, to znaczy na parowanie. Do stu stopni parowanie następuje głównie z powierzchni, a po osiągnięciu tej temperatury woda wrze. Gotowanie to także parowanie, ale tylko w całej objętości cieczy. Wewnątrz wody tworzą się bąbelki z gorącą parą, które są lżejsze od wody i wypływają na powierzchnię, a para z nich wyparowuje do powietrza.
Po podgrzaniu temperatura wody wzrasta do stu stopni. Po stu stopniach, przy dalszym ogrzewaniu, temperatura pary wodnej wzrośnie. Ale dopóki cała woda nie zagotuje się w temperaturze stu stopni, jej temperatura nie wzrośnie, bez względu na to, ile energii włożysz. Ustaliliśmy już, dokąd trafia ta energia - do przejścia wody w stan gazowy. Ale skoro takie zjawisko istnieje, to znaczy, że musi istnieć wielkość fizyczna opisująca to zjawisko. I taka wartość istnieje. Nazywa się to ciepłem właściwym parowania.
Ciepło właściwe parowania wody
Ciepło właściwe parowania jest wielkością fizyczną, która pokazuje ilość ciepła potrzebną do przekształcenia cieczy o masie 1 kg w parę w temperaturze wrzenia. Ciepło właściwe parowania jest oznaczone literą L. Jednostką miary jest dżul na kilogram (1 J/kg).
Ciepło właściwe parowania można obliczyć ze wzoru:
gdzie Q jest ilością ciepła,
m to masa ciała.
Nawiasem mówiąc, wzór jest taki sam, jak przy obliczaniu ciepła właściwego topnienia, jedyna różnica polega na oznaczeniu. λ i L
Eksperymentalnie ustalono wartości ciepła właściwego parowania różnych substancji i opracowano tabele, z których można znaleźć dane dla każdej substancji. Zatem ciepło właściwe parowania wody jest równe 2,3*106 J/kg. Oznacza to, że na każdy kilogram wody trzeba wydać ilość energii równą 2,3 * 106 J, aby zamienić ją w parę. Ale jednocześnie woda musi już mieć temperaturę wrzenia. Jeśli woda miała początkowo niższą temperaturę, należy obliczyć ilość ciepła, która będzie potrzebna do podgrzania wody do stu stopni.
W warunkach rzeczywistych często konieczne jest określenie ilości potrzebnego ciepła przemiana określonej masy dowolnej cieczy w parę, dlatego coraz częściej mamy do czynienia ze wzorem w postaci: Q = Lm, a wartości ciepła właściwego parowania dla konkretnej substancji pobierane są z gotowych tabel.
Na tej lekcji zwrócimy uwagę na ten rodzaj parowania jakim jest gotowanie, omówimy jego różnice w stosunku do omówionego wcześniej procesu parowania, wprowadzimy wartość taką jak temperatura wrzenia oraz omówimy od czego ona zależy. Na koniec lekcji wprowadzimy bardzo ważną wielkość opisującą proces parowania - ciepło właściwe parowania i skraplania.
Temat: Zbiorcze stany materii
Lekcja: Gotowanie. Ciepło właściwe parowania i kondensacji
Na ostatniej lekcji przyjrzeliśmy się już jednemu z rodzajów powstawania pary - parowaniu - i podkreśliliśmy właściwości tego procesu. Dzisiaj omówimy ten rodzaj waporyzacji, proces wrzenia i wprowadzimy wartość liczbową charakteryzującą proces parowania - ciepło właściwe parowania i skraplania.
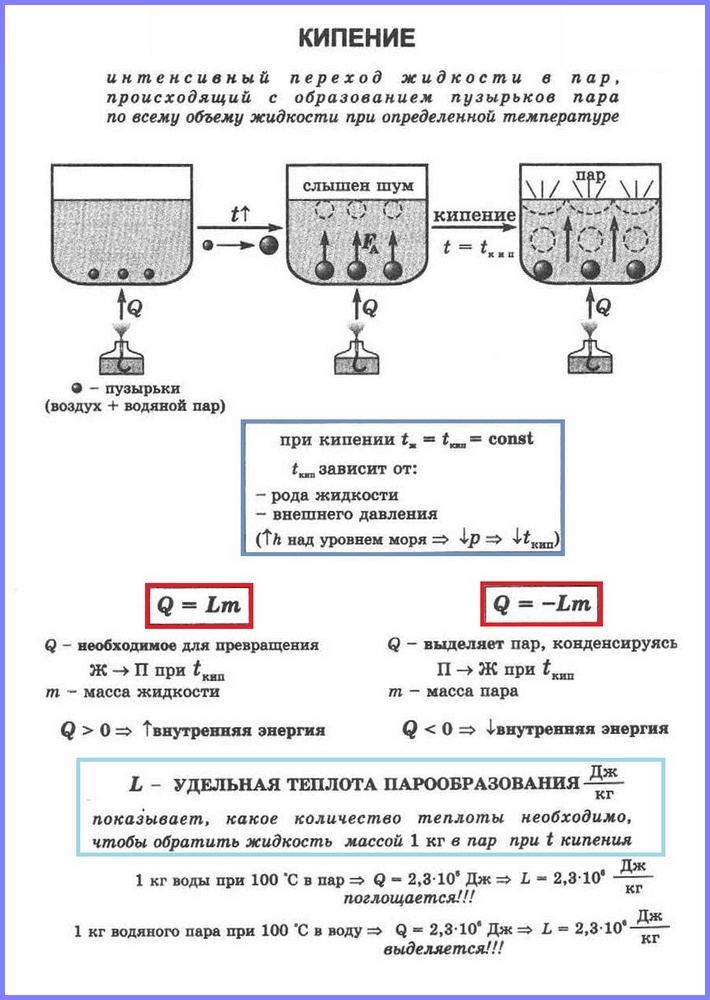
Definicja.Wrzenie(Rys. 1) to proces intensywnego przejścia cieczy w stan gazowy, któremu towarzyszy powstawanie pęcherzyków pary i zachodzący w całej objętości cieczy w określonej temperaturze, zwanej temperaturą wrzenia.
Porównajmy ze sobą oba rodzaje waporyzacji. Proces wrzenia jest bardziej intensywny niż proces parowania. Ponadto, jak pamiętamy, proces parowania zachodzi w dowolnej temperaturze powyżej temperatury topnienia, a proces wrzenia ściśle w określonej temperaturze, która jest inna dla każdej substancji i nazywana jest temperaturą wrzenia. Należy również zaznaczyć, że parowanie zachodzi tylko ze swobodnej powierzchni cieczy, czyli z obszaru oddzielającego ją od otaczających gazów, a wrzenie następuje od razu z całej objętości.
Przyjrzyjmy się bliżej procesowi gotowania. Wyobraźmy sobie sytuację, z którą wielu z nas spotkało się wielokrotnie – podgrzanie i zagotowanie wody w określonym naczyniu, na przykład rondlu. Podczas ogrzewania pewna ilość ciepła zostanie przekazana wodzie, co doprowadzi do wzrostu jej energii wewnętrznej i wzrostu aktywności ruchu molekularnego. Proces ten będzie trwał aż do pewnego etapu, aż energia ruchu molekularnego stanie się wystarczająca do rozpoczęcia wrzenia.
Woda zawiera rozpuszczone gazy (lub inne zanieczyszczenia), które uwalniają się w jej strukturze, co prowadzi do powstania tzw. centrów parowania. Oznacza to, że w tych ośrodkach zaczyna się uwalniać para, a w całej objętości wody tworzą się pęcherzyki, które obserwuje się podczas gotowania. Ważne jest, aby zrozumieć, że te pęcherzyki nie zawierają powietrza, ale parę powstającą podczas procesu wrzenia. Po utworzeniu się pęcherzyków zwiększa się w nich ilość pary i zaczynają się powiększać. Często pęcherzyki początkowo tworzą się w pobliżu ścian naczynia i nie wypływają natychmiast na powierzchnię; najpierw powiększając się, znajdują się pod wpływem rosnącej siły Archimedesa, a następnie odrywają się od ściany i wypływają na powierzchnię, gdzie pękają i uwalniają część pary.
Warto zaznaczyć, że nie wszystkie pęcherzyki pary od razu docierają na swobodną powierzchnię wody. Na początku procesu wrzenia woda nie jest jeszcze równomiernie nagrzana, a dolne warstwy, przy których bezpośrednio zachodzi proces wymiany ciepła, są jeszcze gorętsze niż górne, nawet biorąc pod uwagę proces konwekcji. Prowadzi to do tego, że unoszące się od dołu pęcherzyki pary zapadają się na skutek zjawiska napięcia powierzchniowego, zanim dotrą do swobodnej powierzchni wody. W tym przypadku para znajdująca się wewnątrz pęcherzyków przechodzi do wody, co dodatkowo ją podgrzewa i przyspiesza proces równomiernego podgrzewania wody w całej objętości. W rezultacie, gdy woda nagrzeje się niemal równomiernie, prawie wszystkie pęcherzyki pary zaczynają docierać do powierzchni wody i rozpoczyna się proces intensywnego tworzenia się pary.
Należy podkreślić, że temperatura, w której zachodzi proces wrzenia, pozostaje niezmieniona nawet przy zwiększeniu intensywności dostarczania ciepła do cieczy. W prostych słowach, jeśli podczas procesu gotowania dodasz gaz do palnika, który podgrzewa patelnię z wodą, doprowadzi to jedynie do wzrostu intensywności wrzenia, a nie do wzrostu temperatury cieczy. Jeśli zagłębimy się bardziej w proces wrzenia, warto zauważyć, że w wodzie pojawiają się obszary, w których można ją przegrzać powyżej temperatury wrzenia, ale wielkość takiego przegrzania z reguły nie przekracza jednego lub kilku stopni i jest nieistotny w całkowitej objętości cieczy. Temperatura wrzenia wody pod normalnym ciśnieniem wynosi 100°C.
Podczas procesu gotowania wody można zauważyć, że towarzyszą mu charakterystyczne dźwięki tzw. wrzenia. Dźwięki te powstają właśnie w wyniku opisanego procesu zapadania się pęcherzyków pary.
Procesy wrzenia innych cieczy przebiegają w taki sam sposób, jak wrzenie wody. Główną różnicą w tych procesach są różne temperatury wrzenia substancji, które przy normalnym ciśnieniu atmosferycznym mają już zmierzone wartości tabelaryczne. Główne wartości tych temperatur wskazujemy w tabeli.
Ciekawostką jest to, że temperatura wrzenia cieczy zależy od wartości ciśnienia atmosferycznego, dlatego też wskazaliśmy, że wszystkie wartości w tabeli podane są przy normalnym ciśnieniu atmosferycznym. Wraz ze wzrostem ciśnienia powietrza wzrasta również temperatura wrzenia cieczy, a gdy maleje, wręcz przeciwnie, maleje.
Na tej zależności temperatury wrzenia od ciśnienia środowisko w oparciu o zasadę działania tak znanego urządzenia kuchennego jak szybkowar (ryc. 2). Jest to garnek ze szczelnie przylegającą pokrywką, pod którym w procesie zaparowania wody ciśnienie powietrza z parą osiąga aż do 2 ciśnienia atmosferycznego, co powoduje wzrost temperatury wrzenia znajdującej się w nim wody do . Z tego powodu woda i żywność w niej zawarte mają możliwość podgrzania do temperatury wyższej niż zwykle (), a proces gotowania zostaje przyspieszony. Z powodu tego efektu urządzenie otrzymało swoją nazwę.

Ryż. 2. Szybkowar ()
Sytuacja ze spadkiem temperatury wrzenia cieczy wraz ze spadkiem ciśnienia atmosferycznego też ma przykład z życia, ale już dla wielu osób niecodzienny. Przykład ten dotyczy podróży wspinaczy w rejony wysokogórskie. Okazuje się, że na terenach położonych na wysokościach 3000-5000 m npm temperatura wrzenia wody na skutek spadku ciśnienia atmosferycznego obniża się do niższych wartości, co prowadzi do trudności podczas przygotowywania posiłków podczas pieszych wędrówek, gdyż dla efektywnej obróbki cieplnej produktów w W tym przypadku trwa to znacznie dłużej niż w normalnych warunkach. Na wysokościach około 7000 m npm woda osiąga temperaturę wrzenia , co uniemożliwia gotowanie wielu produktów w takich warunkach.
Niektóre technologie rozdzielania substancji opierają się na tym, że temperatury wrzenia różnych substancji są różne. Przykładowo, jeśli weźmiemy pod uwagę olej opałowy, który jest złożoną cieczą składającą się z wielu składników, to podczas procesu wrzenia można go podzielić na kilka różnych substancji. W w tym przypadku, ze względu na różne temperatury wrzenia nafty, benzyny, nafty i oleju opałowego, można je od siebie oddzielić poprzez odparowanie i kondensację w różnych temperaturach. Proces ten nazywany jest zwykle frakcjonowaniem (ryc. 3).

Ryż. 3 Rozdzielanie oleju na frakcje ()
Jak każdy proces fizyczny, wrzenie należy scharakteryzować za pomocą pewnej wartości liczbowej, wartość tę nazywa się ciepłem właściwym parowania.
Aby zrozumieć fizyczne znaczenie tej wartości, rozważmy następujący przykład: weź 1 kg wody i doprowadź ją do temperatury wrzenia, a następnie zmierz, ile ciepła potrzeba, aby ta woda całkowicie odparowała (bez uwzględnienia strat ciepła) - wartość ta będzie równa ciepłu właściwemu parowania wody. Dla innej substancji ta wartość ciepła będzie inna i będzie ciepłem właściwym parowania tej substancji.
Ciepło właściwe parowania okazuje się być bardzo ważną cechą nowoczesne technologie produkcja metalu. Okazuje się, że na przykład, gdy żelazo topi się i odparowuje, a następnie ulega kondensacji i zestaleniu, komórka kryształowa o strukturze zapewniającej wyższą wytrzymałość niż próbka oryginalna.
Przeznaczenie: ciepło właściwe parowania i skraplania (czasami oznaczane jako ).
Jednostka: .
Ciepło właściwe parowania substancji określa się za pomocą eksperymentów laboratoryjnych, a jego wartości dla substancji podstawowych podano w odpowiedniej tabeli.
|
Substancja |
Nazywa się zjawisko przejścia substancji ze stanu ciekłego w stan gazowy odparowanie. Waporyzację można przeprowadzić w formie dwóch procesów:
Wrzenie
Drugim procesem odparowywania jest gotowanie. Możesz obserwować ten proces za pomocą proste doświadczenie poprzez podgrzanie wody w szklanej kolbie. Gdy woda zostanie podgrzana, po chwili pojawiają się w niej bąbelki zawierające powietrze i nasyconą parę wodną, która powstaje w wyniku odparowania wody wewnątrz bąbelków. Wraz ze wzrostem temperatury wzrasta ciśnienie wewnątrz pęcherzyków, które pod wpływem siły wyporu unoszą się do góry. Ponieważ jednak temperatura górnych warstw wody jest niższa niż dolnych, para w pęcherzykach zaczyna się kondensować i kurczą się. Kiedy woda nagrzeje się w całej objętości, pęcherzyki z parą unoszą się na powierzchnię, pękają i para wychodzi. Woda się gotuje. Dzieje się tak w temperaturze, w której ciśnienie pary nasyconej w pęcherzykach jest równe ciśnieniu atmosferycznemu.
Nazywa się proces parowania, który zachodzi w całej objętości cieczy w określonej temperaturze. Nazywa się temperaturę, w której wrze ciecz temperatura wrzenia.
Temperatura ta zależy od ciśnienia atmosferycznego. Wraz ze wzrostem ciśnienia atmosferycznego wzrasta temperatura wrzenia.
Doświadczenie pokazuje, że podczas procesu wrzenia temperatura cieczy nie ulega zmianie, mimo że energia pochodzi z zewnątrz. Przejście cieczy w stan gazowy w temperaturze wrzenia wiąże się ze wzrostem odległości między cząsteczkami i odpowiednio z pokonaniem przyciągania między nimi. Energia dostarczona do cieczy jest zużywana na wykonanie pracy polegającej na pokonaniu sił przyciągania. Dzieje się tak, dopóki cała ciecz nie zamieni się w parę. Ponieważ ciecz i para mają podczas wrzenia tę samą temperaturę, średnia energia kinetyczna cząsteczek nie zmienia się, wzrasta jedynie ich energia potencjalna.
Rysunek przedstawia wykres temperatury wody w funkcji czasu podczas jej ogrzewania od temperatury pokojowej do temperatury wrzenia (AB), temperatury wrzenia (BC), ogrzewania parą (CD), chłodzenia parą (DE), skraplania (EF) i późniejszego chłodzenia (FG) .
Ciepło właściwe parowania
Do przekształcenia różnych substancji ze stanu ciekłego w stan gazowy potrzebna jest różna energia, energia ta charakteryzuje się wartością zwaną ciepłem właściwym parowania.
Ciepło właściwe parowania (L) to wartość równa stosunkowi ilości ciepła, jaką należy dostarczyć substancji o masie 1 kg, aby w temperaturze wrzenia przeszła ona ze stanu ciekłego w stan gazowy.
Jednostka ciepła właściwego parowania - [ L] = J/kg.
Aby obliczyć ilość ciepła Q, które należy przekazać substancji o masie mn, aby przejść ze stanu ciekłego w stan gazowy, należy zastosować ciepło właściwe parowania ( L) pomnożona przez masę substancji: Q = Lm.
Kiedy para się skrapla, wydziela się pewna ilość ciepła, a jej wartość jest równa ilości ciepła, jaką należy wydać, aby ciecz zamieniła się w parę o tej samej temperaturze.
Specyficzna pojemność cieplna
Ciepło właściwe to ilość ciepła w dżulach (J) potrzebna do podniesienia temperatury substancji. Ciepło właściwe jest funkcją temperatury. W przypadku gazów należy rozróżnić ciepło właściwe przy stałym ciśnieniu i przy stałej objętości.
Ciepło właściwe topnienia
Ciepło właściwe topnienia ciała stałego to ilość ciepła w J potrzebna do przekształcenia 1 kg substancji ze stanu stałego w ciecz w jej temperaturze topnienia.
Utajone ciepło parowania
Utajone ciepło parowania cieczy to ilość ciepła w J potrzebna do odparowania 1 kg cieczy w jej temperaturze wrzenia. Utajone ciepło parowania zależy w dużym stopniu od ciśnienia. Przykład: Jeśli do pojemnika zawierającego 1 kg wody o temperaturze 100°C (na poziomie morza) zostanie doprowadzone ciepło, woda pochłonie 1023 kJ ciepła utajonego bez zmiany wskazania termometru. Nastąpi jednak zmiana stanu skupienia z cieczy na parę. Ciepło pochłonięte przez wodę nazywane jest utajonym ciepłem parowania. Para zatrzyma 1023 kJ, ponieważ energia ta była potrzebna do zmiany stanu skupienia.
Utajone ciepło kondensacji
W procesie odwrotnym, gdy ciepło zostanie usunięte z 1 kg pary wodnej o temperaturze 100°C (na poziomie morza), para wydzieli 1023 kJ ciepła bez zmiany wskazania termometru. Nastąpi jednak zmiana stanu skupienia z pary na ciecz. Ciepło pochłonięte przez wodę nazywane jest utajonym ciepłem kondensacji.
Temperatura i ciśnienie

Pomiary termiczne
Temperaturę lub INTENSYWNOŚĆ ciepła mierzy się za pomocą termometru. Większość temperatur w tej instrukcji wyrażona jest w stopniach Celsjusza (C), ale czasami używa się stopni Fahrenheita (F). Wartość temperatury informuje nas jedynie o intensywności ciepła lub CIEPLE WRAŻLIWYM, a nie o rzeczywistej ilości ciepła. Komfortowa temperatura dla człowieka waha się od 21 do 27°C. W tym zakresie temperatur człowiek czuje się najbardziej komfortowo. Kiedy jakakolwiek temperatura jest powyżej lub poniżej tego zakresu, osoba postrzega ją jako ciepłą lub zimną. W nauce istnieje pojęcie „zera absolutnego” - temperatury, w której całe ciepło jest usuwane z ciała. Temperaturę zera absolutnego definiuje się jako –273°C. Każda substancja o temperaturze wyższej od zera absolutnego zawiera pewną ilość ciepła. Aby zrozumieć podstawy klimatyzacji, konieczne jest również zrozumienie zależności pomiędzy ciśnieniem, temperaturą i stanem skupienia. Naszą planetę otacza powietrze, czyli gaz. Ciśnienie gazu jest przenoszone równomiernie we wszystkich kierunkach. Otaczający nas gaz składa się z 21% tlenu i 78% azotu. Pozostały 1% zajmują inne gazy rzadkie. Ta kombinacja gazów nazywana jest atmosferą. Rozciąga się kilkaset kilometrów nad powierzchnią ziemi i jest utrzymywany przez grawitację. Na poziomie morza ciśnienie atmosferyczne wynosi 1,0 bar, a temperatura wrzenia wody wynosi 100°C. W dowolnym punkcie nad poziomem morza ciśnienie atmosferyczne jest niższe, podobnie jak temperatura wrzenia wody. Gdy ciśnienie spadnie do 0,38 bara, temperatura wrzenia wody wynosi 75°C, a przy ciśnieniu 0,12 bara wynosi 50°C. Jeśli spadek ciśnienia wpływa na temperaturę wrzenia wody, logiczne jest założenie, że wpłynie to również na wzrost ciśnienia. Przykładem jest kocioł parowy!
Informacje dodatkowe: Jak przeliczyć stopnie Fahrenheita na stopnie Celsjusza i odwrotnie: C = 5/9 × (F – 32). F = (9/5 × C)+32. Kelwin = C + 273. Rankine = F + 460.
