Cieľ
Asimilácia a konsolidácia teoretického materiálu na tému termodynamického kurzu „Vodná para“, ako aj osvojenie si metód experimentu a spracovania získaných údajov, oboznámenie sa s tabuľkami „Termofyzikálne vlastnosti vody a pary“.
1. Preštudujte si schému experimentálneho nastavenia, zapnite ho a uveďte do daného stacionárneho tepelného režimu.
2. Vykonajte experiment v súlade s pokynmi, vyplňte tabuľku 1.
3. Určte špecifické teplo vynaložené na vyparovanie vody v experimente.
4. Pre izobarický proces odparovania určte tabuľkové hodnoty parametrov vody na saturačnej čiare a suchej nasýtenej pary, ako aj merné teplo vyparovania.
5. Vypočítajte vnútornú energiu kvapaliny na čiare nasýtenia parou pre podmienky experimentu.
6. Vypočítajte chybu zistenej hodnoty špecifické teplo odparovanie vo vzťahu k tabuľke.
7. Znázornite procesy prebiehajúce v Dewarovej nádobe v P-v a T-s-diagramoch.
8. Urobte záver o práci.
METODICKÉ POKYNY
Prechod látky z kvapalného do plynného skupenstva sa nazýva vyparovanie, spätný prechod sa nazýva kondenzácia. Var kvapaliny je proces vyparovania vo vnútri kvapaliny, ktorý prebieha pri presne definovanej teplote t n, ° C, určenej tlakom. Ak existuje plynná fáza s kvapalnou fázou tej istej látky, potom sa nazýva para. Plynná fáza systému je suchá nasýtená para a kvapalná fáza je kvapalina, ktorá si zachováva stav zodpovedajúci začiatku odparovania.
Pri odparovaní podľa izobaricko-izotermického procesu podľa prvého zákona termodynamiky sa merné teplo fázovej premeny (merné teplo vyparovania) r, J / kg,
r \u003d u "- u" + p (v "-v"), (1)
r = i" - i" , (2)
kde u", ja", v" - vnútorná energia, entalpia, J / kg, a špecifický objem suchej nasýtenej pary, m 3 / kg;
u", i", v" - vnútorná energia, entalpia, J / kg, a špecifický objem kvapaliny v stave nasýtenia, m 3 / kg.
Tlak p, Pa nie je označený špeciálnymi indexmi, pretože sa nemení počas celého fázového prechodu a rovná sa tlaku nasýtenia.
Špecifické teplo vyparovania teda zahŕňa zmenu vnútornej energie látky a prácu zmeny objemu počas fázového prechodu.
Merné výparné teplo funkčne súvisí so stavovými parametrami. Pre väčšinu látok používaných v praxi sú vlastnosti kvapaliny a pár na čiare nasýtenia určené a tabuľkové. Tieto tabuľky uvádzajú hodnoty p a t na čiare nasýtenia a zodpovedajúce hodnoty v", v", i", i", r, s", s". Vnútorná energia kvapaliny na čiare nasýtenia u", J / kg a suchej nasýtenej pary u", J / kg, je určená rovnicami
u"=i"-pv"(3)
u" = i" -pv" (4)
EXPERIMENTÁLNE NASTAVENIE
Kreslenie. Schéma experimentálneho usporiadania
Experimentálna zostava (obrázok) pozostáva z Dewarovej nádoby 1 s elektrickým ohrievačom 2, do ktorej sa naleje časť destilovanej vody z nádoby 3, regulovanej ventilom 4. Výsledná para v kondenzátore 5, cez ktorú sa voda z vodovodu prechádza, mení sa na kvapalinu. Prietok vody je regulovaný ventilom 7 podľa kontrolky 8. Vzniknutý kondenzát sa zhromažďuje v odmernom valci 9. Na ovládacom paneli sú: spínač "SIEŤ" 10, voltmeter 11, ampérmeter 12, prepínač režimu 13; 6 - sklenený lievik.
EXPERIMENTÁLNA TECHNIKA
1. Zapnite jednotku otočením spínača 10 do polohy "1".
2. Skontrolujte plnenie Dewarovej nádoby 1 nastavením prepínača režimu 13 do polohy "PLNENIE". Ak sa súčasne rozsvieti zelená kontrolka „Nádoba je plná“, môžete spustiť experiment. V opačnom prípade sa nádoba naplní destilovanou vodou, pre ktorú sa otvorí ventil 4. Po rozsvietení zelenej kontrolky nádobu pevne uzavrite.
3. Prepnite spínač 13 do polohy "KÚRENIE".
4. Otáčaním gombíka autotransformátora 14 nastavte učiteľom nastavenú hodnotu napätia na ohrievači U, V (a silu prúdu I, A).
5. Otvorením ventilu 7 priveďte chladiacu vodu do kondenzátora 5 a nastavte prietok vody podľa kontrolky 8.
6. Keď je ustálený stacionárny režim varu vody v Dewarovej nádobe (v odmernom valci 9 sa nahromadí 15-20 cm kondenzátu), vykonajte kontrolný odber kondenzátu v množstve, ktoré určí učiteľ (V, m 3). Trvanie kontrolného odberu t, s určujú stopky.
7. Pomocou barometra určte atmosférický tlak P a, mm Hg.
8. Údaje o meraní zapíšte do tabuľky pozorovaní a podpíšte ju s učiteľom.
9. Zapnite jednotku otočením spínača „0“, zatvorte ventil 7, otočte rukoväťou autotransformátora proti smeru hodinových ručičiek až na doraz, vypustite kondenzát do nádoby 3.
stôl 1
|
Číslo merania |
mm. rt. čl. | ||||
SPRACOVANIE EXPERIMENTÁLNYCH ÚDAJOV
1. Vypočítajte množstvo tepla vynaloženého na odparenie 1 kg vody r op, J / kg:
r op = (W - Q) / (Vr),
kde W = UI - výkon ohrievača, W;
Q = 0,04W - tepelné straty, W;
r je hustota kondenzátu, kg/m3. Akceptujeme r \u003d 1000 kg / m 3.
2. Za predpokladu, že voda vrie pri atmosférickom tlaku, určte z tabuľkových hodnôt parametrov vody na saturačnej čiare a suchej nasýtenej pary, ktoré sú uvedené v tabuľke 2.
Tabuľka 2
|
i", kJ/kg |
S", kJ/(kgK) |
i", kJ/kg |
S", J/(kgK) | |||
3. Vypočítajte hodnoty vnútornej energie vody na čiare nasýtenia u" a suchej nasýtenej pary u", kJ/kg, pomocou vzorcov (3) a (4).
4. Vypočítajte chybu % zistenej hodnoty merného tepla vyparovania r op, kJ / kg vo vzťahu k tabuľkovému r, kJ / kg podľa vzorca:
D \u003d (r op - r) 100 / r.
5. Znázornite graficky procesy prebiehajúce v Dewarovej nádobe v P-v a T-s-diagramoch.
6. Urobte záver o práci.
OTÁZKY PRE SEBAVZDELÁVANIE
1. Odparovanie kvapaliny; podstata procesov varu a vyparovania kvapaliny.
2. Izobarický proces prechodu kvapaliny na prehriatu paru v P-v a T-s-diagramoch.
3. Hraničné krivky so stupňom suchosti x = 0 a x = 1, kritický stav látky
4. Pojmy: kvapalina na saturačnej linke, mokrá nasýtená para, suchá nasýtená para, prehriata para.
5. Špecifické teplo vyparovania kvapaliny.
6. Stupeň suchosti, stupeň vlhkosti pary.
7. Tabuľky termofyzikálnych vlastností vody a vodnej pary, ich význam.
8. Stanovenie parametrov mokrej pary.
9. i-s-diagram vodnej pary, jej účel.
10. Termodynamické procesy pary v P-v, T-s, i-s-diagramoch.
LITERATÚRA
1. Tepelná technika / Ed. A.P.Baškaková.- M.: Energoizdat, 1991.- 224 s.
2. Nashchokin V.V. Technická termodynamika a prenos tepla.- M.:: absolventská škola, 1980.- 496 s.
3. Yudaev B.N. Technická termodynamika. Prestup tepla - M .: Vysoká škola, 1998. - 480 s.
4. Rivkin S.L., Aleksandrov A.A. Tabuľky termofyzikálnych vlastností vody a pary.- M.: Energia, 1980.- 408 s.
Viete, aká je teplota uvarenej polievky? 100 ˚С. Nie viac nie menej. Pri rovnakej teplote kanvica vrie a cestoviny sa uvaria. Čo to znamená?
Prečo teplota vody vo vnútri nestúpne nad sto stupňov, keď sa panvica alebo kanvica neustále ohrieva horiacim plynom? Faktom je, že keď voda dosiahne teplotu sto stupňov, všetka prichádzajúca tepelná energia sa vynaloží na prechod vody do plynného stavu, to znamená na odparovanie. Do sto stupňov dochádza k vyparovaniu najmä z povrchu a pri dosiahnutí tejto teploty voda vrie. Var je tiež vyparovanie, ale len po celom objeme kvapaliny. Vo vode sa tvoria bublinky horúcej pary, ktoré sú ľahšie ako voda, vyrážajú na povrch a para z nich uniká do ovzdušia.
Až o sto stupňov teplota vody pri zahriatí stúpa. Po sto stupňoch sa pri ďalšom zahrievaní zvýši teplota vodnej pary. Ale kým sa všetka voda nevyvarí pri sto stupňoch, jej teplota nestúpne, bez ohľadu na to, koľko energie použijete. Už sme prišli na to, kam táto energia smeruje – k prechodu vody do plynného skupenstva. Ale ak takýto jav existuje, potom musí existovať fyzikálna veličina, ktorá tento jav popisuje. A taká hodnota existuje. Nazýva sa špecifické teplo vyparovania.
Špecifické teplo vyparovania vody
Merné teplo vyparovania je fyzikálna veličina, ktorá udáva množstvo tepla potrebného na premenu 1 kg kvapaliny na paru pri bode varu. Špecifické výparné teplo sa označuje písmenom L. A jednotkou merania je joule na kilogram (1 J / kg).
Špecifické teplo vyparovania možno zistiť zo vzorca:
kde Q je množstvo tepla,
m - telesná hmotnosť.
Mimochodom, vzorec je rovnaký ako pri výpočte špecifického tepla topenia, rozdiel je len v označení. λ a L
Empiricky boli zistené hodnoty merného tepla vyparovania rôznych látok a zostavené tabuľky, z ktorých možno nájsť údaje pre každú látku. Merné skupenské teplo vyparovania vody je teda 2,3 x 106 J/kg. To znamená, že na každý kilogram vody sa musí minúť množstvo energie rovnajúce sa 2,3 * 106 J, aby sa premenila na paru. Ale zároveň by už voda mala mať bod varu. Ak mala voda spočiatku nižšiu teplotu, potom je potrebné vypočítať množstvo tepla, ktoré bude potrebné na ohrev vody na sto stupňov.
V reálnych podmienkach je často potrebné určiť množstvo tepla potrebného na premena určitej hmotnosti kvapaliny na paru, preto sa musíme častejšie zaoberať vzorcom v tvare: Q \u003d Lm a hodnoty špecifického tepla vyparovania pre konkrétnu látku sa preberajú z hotových tabuliek.
V tejto lekcii budeme venovať pozornosť takému typu odparovania, ako je varenie, diskutovať o jeho rozdieloch od predtým uvažovaného procesu odparovania, predstavíme takú hodnotu, ako je bod varu, a diskutujeme o tom, od čoho závisí. Na konci lekcie si predstavíme veľmi dôležitú veličinu, ktorá popisuje proces vyparovania – merné teplo vyparovania a kondenzácie.
Téma: Súhrnné stavy hmoty
Poučenie: Varte. Špecifické teplo vyparovania a kondenzácie
V minulej lekcii sme sa už zaoberali jedným z typov vaporizácie – vyparovaním – a zdôraznili sme vlastnosti tohto procesu. Dnes budeme diskutovať o takom type odparovania, akým je proces varu, a predstavíme si hodnotu, ktorá číselne charakterizuje proces odparovania – špecifické teplo vyparovania a kondenzácie.
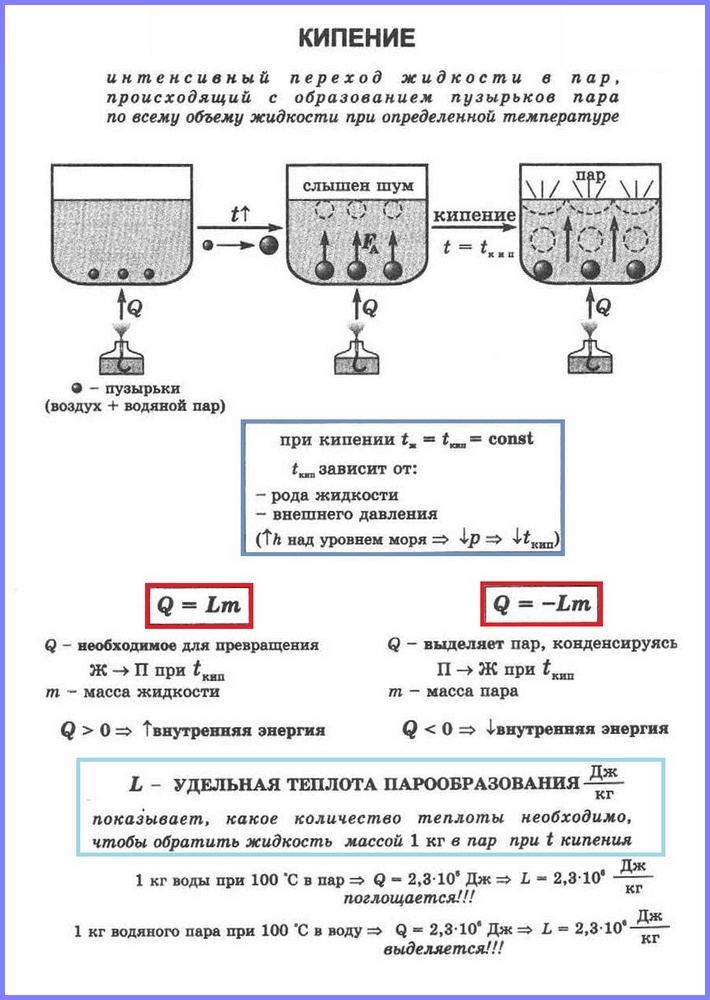
Definícia.Vriaci(obr. 1) je proces intenzívneho prechodu kvapaliny do plynného skupenstva, sprevádzaný tvorbou bublín pary a vyskytujúci sa v celom objeme kvapaliny pri určitej teplote, ktorá sa nazýva bod varu.
Porovnajme medzi sebou dva druhy vaporizácie. Proces varu je intenzívnejší ako proces odparovania. Okrem toho, ako si pamätáme, proces odparovania prebieha pri akejkoľvek teplote nad bodom topenia a proces varu - prísne pri určitej teplote, ktorá je pre každú z látok iná a nazýva sa bod varu. Treba si tiež uvedomiť, že k vyparovaniu dochádza len z voľného povrchu kvapaliny, teda z oblasti, ktorá ju ohraničuje od okolitých plynov a k varu dochádza okamžite z celého objemu.
Pozrime sa podrobnejšie na priebeh procesu varu. Predstavme si situáciu, s ktorou sa mnohí z nás opakovane stretli – ide o ohrievanie a varenie vody v určitej nádobe, napríklad v hrnci. Počas zahrievania sa určité množstvo tepla odovzdá vode, čo povedie k zvýšeniu jej vnútornej energie a zvýšeniu aktivity molekulárneho pohybu. Tento proces bude pokračovať až do určitého štádia, kým energia molekulárneho pohybu nebude dostatočná na to, aby začala vrieť.
Vo vode sú prítomné rozpustené plyny (alebo iné nečistoty), ktoré sa uvoľňujú v jej štruktúre, čo vedie k takzvanému vzniku centier vyparovania. To znamená, že v týchto centrách sa uvoľňuje para a v celom objeme vody sa vytvárajú bubliny, ktoré sa pozorujú počas varu. Je dôležité pochopiť, že tieto bubliny nie sú vzduch, ale para, ktorá sa tvorí počas procesu varu. Po vytvorení bublín sa množstvo pary v nich zvýši a začnú sa zväčšovať. Často sa bubliny spočiatku tvoria v blízkosti stien nádoby a okamžite nevystúpia na povrch; najprv sa zväčšujú a sú pod vplyvom rastúcej Archimedesovej sily a potom sa odtrhnú od steny a vystúpia na povrch, kde prasknú a uvoľnia časť pary.
Treba si uvedomiť, že nie všetky bublinky pary sa dostanú na voľný povrch vody naraz. Na začiatku procesu varu je voda ešte ďaleko od rovnomerného ohrevu a spodné vrstvy, v blízkosti ktorých prebieha proces prenosu tepla, sú ešte horúcejšie ako horné, a to aj s prihliadnutím na konvekčný proces. To vedie k tomu, že bubliny pary stúpajúce zospodu sa v dôsledku javu povrchového napätia zrútia a ešte nedosiahnu voľnú hladinu vody. Para, ktorá bola vo vnútri bublín, zároveň prechádza do vody, čím ju dodatočne ohrieva a urýchľuje proces rovnomerného ohrevu vody v celom objeme. Výsledkom je, že keď sa voda ohrieva takmer rovnomerne, takmer všetky bubliny pary sa začnú dostávať na povrch vody a začína sa proces intenzívneho odparovania.
Je dôležité zdôrazniť skutočnosť, že teplota, pri ktorej prebieha proces varu, zostáva nezmenená, aj keď sa intenzita prívodu tepla do kvapaliny zvýši. Jednoducho povedané Ak sa počas procesu varu pridá plyn do horáka, ktorý ohrieva hrniec s vodou, zvýši to iba intenzitu varu a nezvýši teplotu kvapaliny. Ak sa vážnejšie ponoríme do procesu varu, stojí za zmienku, že vo vode existujú oblasti, v ktorých sa môže prehriať nad bod varu, ale veľkosť takéhoto prehriatia spravidla nepresahuje jeden alebo niekoľko stupňa a je nevýznamná v celkovom objeme kvapaliny. Teplota varu vody pri normálnom tlaku je 100°C.
V procese vriacej vody si môžete všimnúť, že ju sprevádzajú charakteristické zvuky takzvaného kypenia. Tieto zvuky vznikajú práve kvôli opísanému procesu kolapsu bublín pary.
Procesy varu iných kvapalín prebiehajú rovnakým spôsobom ako varenie vody. Hlavným rozdielom v týchto procesoch sú rozdielne teploty varu látok, ktoré sú pri normálnom atmosférickom tlaku už namerané tabuľkové hodnoty. Uveďme hlavné hodnoty týchto teplôt v tabuľke.
Zaujímavosťou je, že bod varu kvapalín závisí od hodnoty atmosférického tlaku, preto sme uviedli, že všetky hodnoty v tabuľke sú uvedené pri normálnom atmosférickom tlaku. Pri zvýšení tlaku vzduchu sa zvyšuje aj bod varu kvapaliny a pri jeho znižovaní naopak klesá.
Na tejto závislosti teploty varu od tlaku životné prostredie vychádza z princípu fungovania takého známeho kuchynského spotrebiča, akým je tlakový hrniec (obr. 2). Ide o panvicu s tesne priliehajúcim vekom, pod ktorým v procese odparovania vody tlak vzduchu s parou dosahuje hodnoty až 2 atmosférických tlakov, čo vedie k zvýšeniu bodu varu vody v nej. do . Z tohto dôvodu má voda s jedlom v nej možnosť zahriať sa na teplotu vyššiu ako zvyčajne () a proces varenia sa urýchli. Kvôli tomuto efektu dostalo zariadenie svoje meno.

Ryža. 2. Tlakový hrniec ()
Situácia s poklesom bodu varu kvapaliny s poklesom atmosférického tlaku má tiež príklad zo života, no pre mnohých už nie každodenný. Tento príklad platí pre cestovanie horolezcov na vysočine. Ukazuje sa, že v oblasti nachádzajúcej sa v nadmorskej výške 3000-5000 m sa bod varu vody v dôsledku poklesu atmosférického tlaku znižuje na ešte nižšie hodnoty, čo vedie k ťažkostiam pri varení na túrach, pretože pre efektívne teplo ošetrenie výrobkov v V tomto prípade je potrebný oveľa dlhší čas ako za normálnych podmienok. Vo výškach okolo 7000 m dosahuje bod varu vody , čo znemožňuje varenie mnohých produktov v takýchto podmienkach.
Niektoré technológie na separáciu látok sú založené na skutočnosti, že teploty varu rôznych látok sú rôzne. Napríklad, ak vezmeme do úvahy zahrievanie oleja, čo je zložitá kvapalina pozostávajúca z mnohých zložiek, potom ju možno v procese varu rozdeliť na niekoľko rôznych látok. IN tento prípad, vzhľadom na to, že teploty varu petroleja, benzínu, ťažkého benzínu a vykurovacieho oleja sú rozdielne, možno ich od seba oddeliť odparovaním a kondenzáciou pri rôznych teplotách. Tento proces sa zvyčajne označuje ako frakcionácia (obr. 3).

Ryža. 3 Separácia oleja na frakcie ()
Ako každý fyzikálny proces, var musí byť charakterizovaný pomocou nejakej číselnej hodnoty, takáto hodnota sa nazýva špecifické teplo vyparovania.
Aby ste pochopili fyzikálny význam tohto množstva, zvážte nasledujúci príklad: vezmite 1 kg vody a priveďte ho k bodu varu, potom zmerajte, koľko tepla je potrebné na úplné odparenie tejto vody (okrem tepelných strát) - táto hodnota bude sa rovná mernému teplu vyparovania vody. Pre inú látku bude táto hodnota tepla iná a bude to špecifické teplo vyparovania tejto látky.
Špecifické teplo vyparovania sa ukazuje ako veľmi dôležitá charakteristika moderné technológie kovovýroba. Ukazuje sa, že napríklad pri tavení a vyparovaní železa, po ktorom nasleduje jeho kondenzácia a tuhnutie, krištáľová bunka so štruktúrou, ktorá poskytuje vyššiu pevnosť ako pôvodná vzorka.
Označenie: špecifické teplo vyparovania a kondenzácie (niekedy označené ako ).
Jednotka: .
Špecifické teplo odparovania látok sa určuje experimentmi v laboratórnych podmienkach a jeho hodnoty pre hlavné látky sú uvedené v príslušnej tabuľke.
|
Látka |
Proces zmeny látky z kvapalného skupenstva do plynného skupenstva sa nazýva odparovanie. Odparovanie sa môže uskutočňovať vo forme dvoch procesov: i.
Vriaci
Druhým procesom odparovania je varenie. Tento proces môžete sledovať pomocou jednoduchá skúsenosť ohrev vody v sklenenej banke. Pri ohrievaní vody sa v nej po chvíli objavia bublinky, ktoré obsahujú vzduch a nasýtenú vodnú paru, ktorá vzniká pri vyparovaní vody vo vnútri bublín. Keď teplota stúpa, tlak vo vnútri bublín sa zvyšuje a pôsobením vztlakovej sily stúpajú nahor. Keďže je však teplota horných vrstiev vody nižšia ako spodných, para v bublinkách začne kondenzovať a tie sa sťahujú. Keď sa voda zohreje v celom objeme, bublinky s parou vystúpia na povrch, prasknú a para vyjde von. Voda vrie. K tomu dochádza pri teplote, pri ktorej sa tlak nasýtených pár v bublinách rovná atmosférickému tlaku.
Proces vyparovania prebiehajúci v celom objeme kvapaliny pri určitej teplote sa nazýva. Teplota, pri ktorej kvapalina vrie, sa nazýva bod varu.
Táto teplota závisí od atmosférického tlaku. So stúpajúcim atmosférickým tlakom stúpa bod varu.
Skúsenosti ukazujú, že počas procesu varu sa teplota kvapaliny nemení, napriek tomu, že energia prichádza zvonku. Prechod kvapaliny do plynného stavu pri teplote varu je spojený so zväčšením vzdialenosti medzi molekulami, a teda s prekonaním príťažlivosti medzi nimi. Energia dodávaná kvapaline sa vynakladá na vykonanie práce na prekonanie príťažlivých síl. To sa deje, kým sa všetka kvapalina nezmení na paru. Keďže kvapalina a para majú počas procesu varu rovnakú teplotu, priemerná kinetická energia molekúl sa nemení, iba sa zvyšuje ich potenciálna energia.
Obrázok ukazuje graf závislosti teploty vody od času počas jej ohrevu z izbovej teploty na var (AB), var (BC), ohrev parou (CD), chladenie parou (DE), kondenzáciu (EF) a následné ochladzovanie (FG) .
Špecifické teplo vyparovania
Na premenu rôznych látok z kvapalného skupenstva do plynného skupenstva je potrebná rôzna energia, túto energiu charakterizuje hodnota nazývaná špecifické teplo vyparovania.
Špecifické teplo vyparovania (L) je hodnota rovnajúca sa pomeru množstva tepla, ktoré sa musí odovzdať látke s hmotnosťou 1 kg na jej premenu z kvapalného skupenstva do plynného skupenstva pri bode varu.
Jednotkou špecifického tepla vyparovania je [ L] = J/kg.
Na výpočet množstva tepla Q, ktoré je potrebné odovzdať látke s hmotnosťou mn na jej premenu z kvapalného skupenstva na plynné, je potrebné mať merné skupenské teplo vyparovania ( L) krát hmotnosť látky: Q = Lm.
Pri kondenzácii pary sa uvoľňuje určité množstvo tepla a jeho hodnota sa rovná hodnote množstva tepla, ktoré je potrebné vynaložiť na premenu kvapaliny na paru pri rovnakej teplote.
Špecifické teplo
Špecifická tepelná kapacita je množstvo tepla v jouloch (J) potrebné na zvýšenie teploty látky. Špecifická tepelná kapacita je funkciou teploty. Pri plynoch treba rozlišovať medzi špecifickým teplom pri konštantnom tlaku a pri konštantnom objeme.
Špecifické teplo topenia
Špecifické teplo topenia tuhej látky je množstvo tepla v J potrebné na premenu 1 kg látky z tuhého do kvapalného stavu pri teplote topenia.
Latentné teplo vyparovania
Latentné teplo vyparovania kvapaliny je množstvo tepla v J potrebné na odparenie 1 kg kvapaliny pri bode varu. Latentné teplo vyparovania je vysoko závislé od tlaku. Príklad: ak sa na nádobu obsahujúcu 1 kg vody s teplotou 100°C (na úrovni mora) aplikuje teplo, voda absorbuje 1023 kJ latentného tepla bez akejkoľvek zmeny na teplomere. Avšak dôjde k zmene stavu agregácie z kvapaliny na paru. Teplo absorbované vodou sa nazýva latentné teplo vyparovania. Para ušetrí 1023 kJ, keďže táto energia bola potrebná na zmenu stavu agregácie.
Latentné kondenzačné teplo
V opačnom prípade, keď sa odoberie teplo z 1 kg vodnej pary pri 100 °C (na hladine mora), para uvoľní 1023 kJ tepla bez zmeny údajov teplomera. Avšak dôjde k zmene stavu agregácie z pary na kvapalinu. Teplo absorbované vodou sa nazýva latentné kondenzačné teplo.
Teplota a tlak

Tepelné merania
Teplota alebo INTENZITA tepla sa meria teplomerom. Väčšina teplôt v tejto príručke je uvedená v stupňoch Celzia (C), ale niekedy sa používajú aj stupne Fahrenheita (F). Hodnota teploty vypovedá iba o intenzite tepla alebo citeľného HEAT, a nie o skutočnom množstve tepla. Pohodlná teplota pre človeka je v rozmedzí od 21 do 27°C. V tomto teplotnom rozsahu sa človek cíti najpohodlnejšie. Keď je akákoľvek teplota nad alebo pod týmto rozsahom, človek to vníma ako teplý alebo studený. Vo vede existuje pojem "absolútna nula" - teplota, pri ktorej sa z tela odoberá všetko teplo. Teplota absolútnej nuly je definovaná ako -273°C. Každá látka s teplotou nad absolútnou nulou obsahuje určité množstvo tepla. Na pochopenie základov klimatizácie je tiež potrebné pochopiť vzťah medzi tlakom, teplotou a stavom agregácie. Naša planéta je obklopená vzduchom, inými slovami plynom. Tlak v plyne sa prenáša rovnako vo všetkých smeroch. Plyn okolo nás obsahuje 21 % kyslíka a 78 % dusíka. Zvyšné 1 % zaberajú iné vzácne plyny. Táto kombinácia plynov sa nazýva atmosféra. Rozprestiera sa niekoľko stoviek kilometrov nad zemským povrchom a drží ho pohromade gravitačná sila. Na hladine mora je atmosférický tlak 1,0 bar a teplota varu vody je 100°C. V ktoromkoľvek bode nad hladinou mora je atmosférický tlak nižší a bod varu vody je tiež nižší. Pri znížení tlaku na 0,38 bar je bod varu vody 75°C a pri tlaku 0,12 baru - 50°C. Ak je bod varu vody ovplyvnený poklesom tlaku, je logické predpokladať, že ho ovplyvní aj zvýšenie tlaku. Príkladom je parný kotol!
Ďalšie informácie: ako previesť stupne Fahrenheita na stupne Celzia a naopak: C = 5/9 × (F - 32). F = (9/5 x C) + 32. Kelvin = C + 273. Rankin = F + 460.
