Čo sa na sporáku rýchlejšie zohreje - rýchlovarná kanvica alebo vedro vody? Odpoveď je zrejmá – rýchlovarná kanvica. Potom je druhá otázka prečo?
Odpoveď nie je o nič menej zrejmá - pretože množstvo vody v kanvici je menšie. Skvelé. A teraz si ten najskutočnejší fyzický zážitok môžete urobiť sami doma. Na to budete potrebovať dva rovnaké malé hrnce, rovnaké množstvo vody a rastlinného oleja, napríklad pol litra a sporák. Dajte hrnce s olejom a vodou na rovnaký oheň. A teraz už len sledujte, čo sa rýchlejšie zahreje. Ak existuje teplomer na tekutiny, môžete ho použiť, ak nie, teplotu môžete len občas vyskúšať prstom, len pozor, aby ste sa nepopálili. V každom prípade čoskoro uvidíte, že olej sa zohrieva podstatne rýchlejšie ako voda. A ešte jedna otázka, ktorá sa dá realizovať aj formou zážitku. Čo vrie rýchlejšie – teplá voda alebo studená? Všetko je opäť zrejmé – prvý skončí ten teplý. Prečo všetky tieto zvláštne otázky a skúsenosti? Aby bolo možné určiť fyzikálne množstvo nazývané "množstvo tepla."
Množstvo tepla
Množstvo tepla je energia, ktorú telo stráca alebo získava pri prenose tepla. To je jasné už z názvu. Pri ochladzovaní telo stratí určité množstvo tepla a pri zahriatí ho absorbuje. A odpovede na naše otázky nám ukázali od čoho závisí množstvo tepla? Po prvé, čím väčšia je hmotnosť telesa, tým väčšie množstvo tepla musí byť vynaložené na zmenu jeho teploty o jeden stupeň. Po druhé, množstvo tepla potrebného na zahriatie telesa závisí od látky, z ktorej sa skladá, teda od druhu látky. A po tretie, pre naše výpočty je dôležitý aj rozdiel telesnej teploty pred a po prestupe tepla. Na základe vyššie uvedeného môžeme určte množstvo tepla podľa vzorca:
kde Q je množstvo tepla,
m - telesná hmotnosť,
(t_2-t_1) - rozdiel medzi počiatočnou a konečnou telesnou teplotou,
c - merná tepelná kapacita látky, zistí sa z príslušných tabuliek.
Pomocou tohto vzorca môžete vypočítať množstvo tepla, ktoré je potrebné na zahriatie akéhokoľvek telesa alebo ktoré toto teleso uvoľní, keď sa ochladí.
Množstvo tepla sa meria v jouloch (1 J), ako každá iná forma energie. Táto hodnota však bola zavedená nie tak dávno a ľudia začali merať množstvo tepla oveľa skôr. A použili jednotku, ktorá je v našej dobe široko používaná - kalória (1 cal). 1 kalória je množstvo tepla potrebné na zvýšenie teploty 1 gramu vody o 1 stupeň Celzia. Na základe týchto údajov si milovníci počítania kalórií v jedle, ktoré jedia, môžu pre zaujímavosť vypočítať, koľko litrov vody sa dá uvariť s energiou, ktorú počas dňa skonzumujú s jedlom.
730. Prečo sa voda používa na chladenie niektorých mechanizmov?
Voda má skvelú špecifické teplo, čo prispieva k dobrému odvodu tepla z mechanizmu.
731. V akom prípade treba vynaložiť viac energie: na zohriatie jedného litra vody o 1 °C alebo na zohriatie sto gramov vody o 1 °C?
Na zahriatie litra vody, pretože čím väčšia je hmotnosť, tým viac energie je potrebné minúť.
732. Kupronickel a strieborné vidličky rovnakej hmotnosti sa ponorili do horúcej vody. Prijímajú rovnaké množstvo tepla z vody?
Kuproniklová vidlica dostane viac tepla, pretože špecifické teplo kupronického niklu je väčšie ako striebra.
733. Kus olova a kus liatiny rovnakej hmotnosti bol trikrát udieraný perlíkom. Ktorá časť bola teplejšia?
Olovo sa zahreje viac, pretože jeho špecifická tepelná kapacita je menšia ako u liatiny a na ohrev olova je potrebných menej energie.
734. Jedna banka obsahuje vodu, druhá obsahuje petrolej rovnakej hmotnosti a teploty. Do každej banky sa hodila rovnako zahriata železná kocka. Čo sa zohreje na vyššiu teplotu - voda alebo petrolej?
Petrolej.
735. Prečo sú teplotné výkyvy v zime a v lete v mestách na pobreží menej prudké ako v mestách vo vnútrozemí?
Voda sa ohrieva a ochladzuje pomalšie ako vzduch. V zime sa ochladzuje a presúva teplé vzduchové hmoty na pevninu, čím sa klíma na pobreží otepľuje.
736. Špecifické teplo hliníka je 920 J/kg °C. Čo to znamená?
To znamená, že na zahriatie 1 kg hliníka o 1 °C je potrebných 920 J.
737. Hliníkové a medené tyče rovnakej hmotnosti 1 kg sa ochladia o 1 °C. Ako veľmi sa zmení vnútorná energia každého bloku? Ktorá lišta sa zmení viac a o koľko?
738. Aké množstvo tepla je potrebné na zohriatie kilogramového železného predliatku o 45 °C?
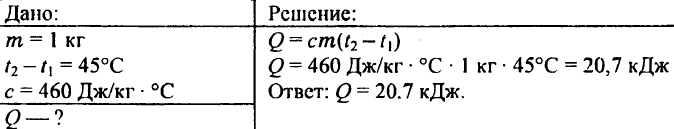
739. Koľko tepla je potrebné na zohriatie 0,25 kg vody z 30 °C na 50 °C?

740. Ako sa zmení vnútorná energia dvoch litrov vody pri zahriatí o 5 °C?

741. Koľko tepla je potrebné na zohriatie 5 g vody z 20 °C na 30 °C?

742. Aké množstvo tepla je potrebné na zahriatie hliníkovej gule s hmotnosťou 0,03 kg na 72 °C?

743. Vypočítajte množstvo tepla potrebného na zohriatie 15 kg medi o 80 °C.

744. Vypočítajte množstvo tepla potrebného na zahriatie 5 kg medi z 10 °C na 200 °C.
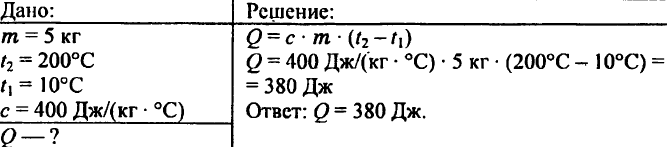
745. Aké množstvo tepla je potrebné na zohriatie 0,2 kg vody z 15 °C na 20 °C?

746. Voda s hmotnosťou 0,3 kg sa ochladila o 20 °C. O koľko sa zníži vnútorná energia vody?

747. Koľko tepla je potrebné na zohriatie 0,4 kg vody s teplotou 20 °C na teplotu 30 °C?

748. Koľko tepla sa spotrebuje na ohrev 2,5 kg vody o 20 °C?
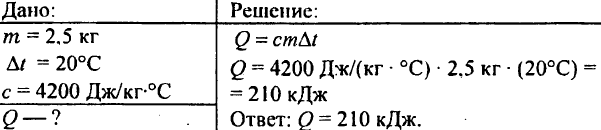
749. Koľko tepla sa uvoľnilo, keď sa 250 g vody ochladilo z 90 °C na 40 °C?

750. Aké množstvo tepla je potrebné na ohriatie 0,015 litra vody o 1 °C?

751. Vypočítajte množstvo tepla potrebného na ohrev jazierka s objemom 300 m3 o 10 °C?

752. Koľko tepla treba odovzdať 1 kg vody, aby sa jej teplota zvýšila z 30 °C na 40 °C?
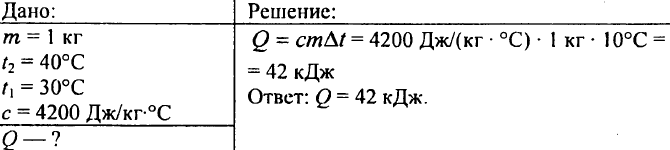
753. Voda s objemom 10 litrov sa ochladila z teploty 100 °C na teplotu 40 °C. Koľko tepla sa v tomto prípade uvoľní?

754. Vypočítajte množstvo tepla potrebného na zohriatie 1 m3 piesku o 60 °C.

755. Objem vzduchu 60 m3, merná tepelná kapacita 1000 J/kg °C, hustota vzduchu 1,29 kg/m3. Koľko tepla je potrebné na zvýšenie teploty na 22 °C?

756. Voda sa ohriala o 10 °C, pričom sa spotrebovalo 4,20 103 J tepla. Určte množstvo vody.

757. Voda s hmotnosťou 0,5 kg vykázala 20,95 kJ tepla. Aká bola teplota vody, ak bola počiatočná teplota vody 20°C?
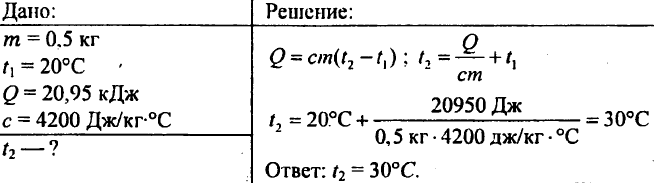
758. Do medeného hrnca s hmotnosťou 2,5 kg sa naleje 8 kg vody s teplotou 10 °C. Koľko tepla je potrebné na privedenie vody do varu v hrnci?

759. Liter vody s teplotou 15 °C sa naleje do medenej naberačky s hmotnosťou 300 g Koľko tepla je potrebné na zohriatie vody v naberačke o 85 °C?

760. Kus vyhriatej žuly s hmotnosťou 3 kg sa vloží do vody. Žula odovzdá vode 12,6 kJ tepla, chladenie o 10 °C. Aká je špecifická tepelná kapacita kameňa?

761. Horúca voda s teplotou 50 °C sa pridala k 5 kg vody s teplotou 12 °C, čím sa získala zmes s teplotou 30 °C. Koľko vody sa pridalo?

762. Voda s teplotou 20 °C sa pridala do 3 litrov vody s teplotou 60 °C, čím sa získala voda s teplotou 40 °C. Koľko vody sa pridalo?

763. Aká bude teplota zmesi, ak sa 600 g vody 80 °C zmieša s 200 g vody 20 °C?

764. Liter vody s teplotou 90 °C sa nalial do vody s teplotou 10 °C a teplota vody dosiahla 60 °C. Koľko bolo studená voda?

765. Urči, koľko naliať do nádoby horúca voda, zahriaty na 60 ° C, ak nádoba už obsahuje 20 litrov studenej vody s teplotou 15 ° C; teplota zmesi by mala byť 40 °C.

766. Určte, koľko tepla je potrebné na zohriatie 425 g vody o 20 °C.

767. O koľko stupňov sa ohreje 5 kg vody, ak voda prijme 167,2 kJ?

768. Koľko tepla je potrebné na zohriatie m gramov vody pri teplote t1 na teplotu t2?
769. 2 kg vody sa naleje do kalorimetra s teplotou 15 °C. Na akú teplotu sa zohreje voda v kalorimetri, ak sa do nej spustí mosadzné závažie s hmotnosťou 500 g zohriate na 100 °C? Špecifická tepelná kapacita mosadze je 0,37 kJ/(kg °C).
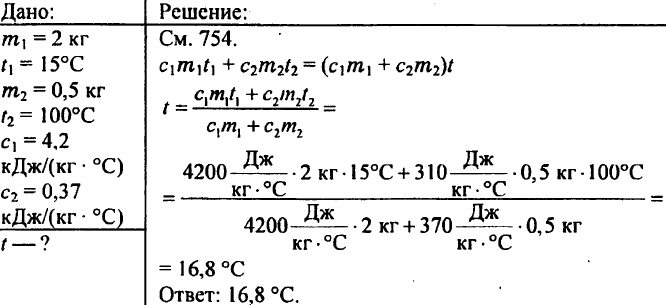
770. Sú tam kusy medi, cínu a hliníka rovnakého objemu. Ktorý z týchto kúskov má najväčšiu a ktorý najmenšiu tepelnú kapacitu?

771. Do kalorimetra sa nalialo 450 g vody, ktorej teplota je 20 °C. Keď sa do tejto vody ponorilo 200 g železných pilín zohriatych na 100 °C, teplota vody dosiahla 24 °C. Určte špecifickú tepelnú kapacitu pilín.

772. Medený kalorimeter s hmotnosťou 100 g pojme 738 g vody, ktorej teplota je 15 °C. Do tohto kalorimetra sa spustilo 200 g medi pri teplote 100 °C, potom teplota kalorimetra stúpla na 17 °C. Aká je špecifická tepelná kapacita medi?

773. Oceľová guľa s hmotnosťou 10 g sa vyberie z pece a spustí sa do vody s teplotou 10 °C. Teplota vody vystúpila na 25°C. Aká bola teplota gule v peci, ak hmotnosť vody bola 50 g? Merná tepelná kapacita ocele je 0,5 kJ/(kg °C).

777. 50 g vody s teplotou 19 °C sa naleje do vody s hmotnosťou 150 g s teplotou 35 °C. Aká je teplota zmesi?

778. Do liatinového kotla s hmotnosťou 2 kg sa pri teplote 10 °C naliala voda s hmotnosťou 5 kg s teplotou 90 °C. Aká bola teplota vody?

779. Oceľové dláto s hmotnosťou 2 kg sa zahrialo na teplotu 800 °C a potom sa spustilo do nádoby obsahujúcej 15 litrov vody s teplotou 10 °C. Na akú teplotu sa zohreje voda v nádobe?

(Indikácia. Na vyriešenie tohto problému je potrebné vytvoriť rovnicu, v ktorej sa požadovaná teplota vody v nádobe po spustení rezačky berie ako neznáma.)
780. Akú teplotu získa voda, ak zmiešate 0,02 kg vody s teplotou 15 °C, 0,03 kg vody s teplotou 25 °C a 0,01 kg vody s teplotou 60 °C?

781. Vykurovanie dobre vetranej triedy si vyžaduje množstvo tepla 4,19 MJ za hodinu. Voda vstupuje do vykurovacích radiátorov s teplotou 80 °C a vystupuje s teplotou 72 °C. Koľko vody treba dodať do radiátorov každú hodinu?

782. Olovo s hmotnosťou 0,1 kg pri teplote 100 °C bolo ponorené do hliníkového kalorimetra s hmotnosťou 0,04 kg s obsahom 0,24 kg vody s teplotou 15 °C. Potom bola v kalorimetri nastavená teplota 16 °C. Aká je špecifická tepelná kapacita olova?

Tepelná kapacita je množstvo tepla, ktoré telo absorbuje pri zahriatí o 1 stupeň.
Tepelná kapacita telesa je označená veľkými písmenami latinské písmeno S.
Čo určuje tepelnú kapacitu telesa? V prvom rade z jeho masy. Je jasné, že ohriatie napríklad 1 kilogramu vody bude vyžadovať viac tepla ako ohriatie 200 gramov.
A čo druh látky? Urobme experiment. Zoberme si dve rovnaké nádoby a do jednej z nich nalejeme vodu s hmotnosťou 400 g a do druhej rastlinný olej s hmotnosťou 400 g a začneme ich ohrievať pomocou rovnakých horákov. Pozorovaním údajov teplomerov uvidíme, že sa olej rýchlo zohreje. Aby sa voda a olej zohriali na rovnakú teplotu, musí sa voda ohrievať dlhšie. Ale čím dlhšie vodu ohrievame, tým viac tepla dostáva od horáka.
Na zahriatie rovnakej hmoty rôznych látok na rovnakú teplotu je teda potrebné rôzne množstvo tepla. Množstvo tepla potrebného na zahriatie telesa a následne aj jeho tepelná kapacita závisí od druhu látky, z ktorej sa teleso skladá.
Napríklad na zvýšenie teploty 1 kg vody o 1 °C je potrebné množstvo tepla rovnajúce sa 4200 J a na zahriatie rovnakej hmotnosti slnečnicového oleja o 1 °C množstvo tepla rovnajúce sa 1 700 J. Vyžaduje sa J.
Fyzikálne množstvo ukazujúce, koľko tepla je potrebné na zahriatie 1 kg látky o 1 ºС, sa nazýva špecifické teplo túto látku.
Každá látka má svoju špecifickú tepelnú kapacitu, ktorá sa označuje latinským písmenom c a meria sa v jouloch na kilogram-stupeň (J / (kg ° C)).
Merná tepelná kapacita tej istej látky v rôznych agregovaných skupenstvách (tuhé, kvapalné a plynné) je rôzna. Napríklad merná tepelná kapacita vody je 4200 J/(kg ºС) a merná tepelná kapacita ľadu je 2100 J/(kg ºС); hliník v pevnom stave má špecifickú tepelnú kapacitu 920 J / (kg - ° C) a v kvapalnom stave - 1080 J / (kg - ° C).
Všimnite si, že voda má veľmi vysokú špecifickú tepelnú kapacitu. Preto voda v moriach a oceánoch, ktorá sa v lete zahrieva, absorbuje veľké množstvo tepla zo vzduchu. Z tohto dôvodu na miestach, ktoré sa nachádzajú v blízkosti veľkých vodných plôch, leto nie je také horúce ako na miestach ďaleko od vody.
Výpočet množstva tepla potrebného na zahriatie telesa alebo ním uvoľneného pri ochladzovaní.
Z uvedeného je zrejmé, že množstvo tepla potrebného na zahriatie telesa závisí od druhu látky, z ktorej sa teleso skladá (t. j. jeho mernej tepelnej kapacity) a od hmotnosti telesa. Je tiež jasné, že množstvo tepla závisí od toho, o koľko stupňov sa chystáme zvýšiť telesnú teplotu.
Takže na určenie množstva tepla potrebného na zahriatie telesa alebo ním uvoľneného počas chladenia je potrebné vynásobiť špecifické teplo telesa jeho hmotnosťou a rozdielom medzi jeho konečnou a počiatočnou teplotou:
Q= cm (t 2 - t 1),
Kde Q- množstvo tepla, c- Špecifická tepelná kapacita, m- telesná hmotnosť, t1- počiatočná teplota, t2- konečná teplota.
Keď je telo zahriate t2> t1 a preto Q >0 . Keď je telo vychladnuté t 2and< t1 a preto Q< 0 .
Ak je známa tepelná kapacita celého tela S, Q sa určuje podľa vzorca: Q \u003d C (t 2 - t1).
22) Tavenie: definícia, výpočet množstva tepla na tavenie alebo tuhnutie, merné teplo tavenia, graf t 0 (Q).
Termodynamika
Odvetvie molekulárnej fyziky, ktoré študuje prenos energie, vzorce transformácie niektorých druhov energie na iné. Na rozdiel od molekulárno-kinetickej teórie termodynamika nezohľadňuje vnútornú štruktúru látok a mikroparametre.
Termodynamický systém
Ide o súbor telies, ktoré si navzájom alebo medzi sebou vymieňajú energiu (vo forme práce alebo tepla). životné prostredie. Napríklad voda v kanvici sa ochladzuje, dochádza k výmene tepla vody s kanvicou a kanvice s okolím. Valec s plynom pod piestom: piest vykonáva prácu, v dôsledku čoho plyn dostáva energiu a menia sa jeho makro parametre.
Množstvo tepla
Toto energie, ktorý prijíma alebo dáva systém v procese výmeny tepla. Označené symbolom Q, merané ako každá energia v jouloch.
V dôsledku rôznych procesov prenosu tepla sa prenášaná energia určuje vlastným spôsobom.
Kúrenie a chladenie
Tento proces je charakterizovaný zmenou teploty systému. Množstvo tepla je určené vzorcom

Merná tepelná kapacita látky s merané množstvom tepla potrebného na zahriatie hmotnostných jednotiek danej látky za 1 tis. Ohrev 1 kg skla alebo 1 kg vody vyžaduje iné množstvo energie. Merná tepelná kapacita je známa hodnota už vypočítaná pre všetky látky, pozri hodnotu vo fyzikálnych tabuľkách.
Tepelná kapacita látky C- toto je množstvo tepla, ktoré je potrebné na zahriatie tela bez zohľadnenia jeho hmotnosti o 1K.


Topenie a kryštalizácia
Topenie je prechod látky z pevného do kvapalného stavu. Reverzný prechod sa nazýva kryštalizácia.
Energia vynaložená na ničenie kryštálová mriežka látok, sa určuje podľa vzorca


Špecifické teplo hodnota topenia známa pre každú látku, pozri hodnotu vo fyzikálnych tabuľkách.
Vyparovanie (vyparovanie alebo varenie) a kondenzácia
Vyparovanie je prechod látky z kvapalného (tuhého) do plynného skupenstva. Opačný proces sa nazýva kondenzácia.


Špecifické výparné teplo je známa hodnota pre každú látku, pozri hodnotu vo fyzikálnych tabuľkách.
Spaľovanie
Množstvo tepla uvoľneného pri horení látky


Špecifické spalné teplo je známa hodnota pre každú látku, pozri hodnotu vo fyzikálnych tabuľkách.
Pre uzavretú a adiabaticky izolovanú sústavu telies je rovnica tepelnej bilancie splnená. Algebraický súčet množstva tepla odovzdaného a prijatého všetkými telesami zúčastňujúcimi sa výmeny tepla sa rovná nule:
Q1+Q2+...+Qn=0
23) Štruktúra kvapalín. povrchová vrstva. Sila povrchového napätia: príklady prejavu, výpočet, koeficient povrchového napätia.
Z času na čas sa môže ktorákoľvek molekula presunúť na susedné voľné miesto. Takéto skoky v kvapalinách sa vyskytujú pomerne často; preto molekuly nie sú viazané na určité centrá ako v kryštáloch a môžu sa pohybovať v celom objeme kvapaliny. To vysvetľuje tekutosť kvapalín. Vďaka silnej interakcii medzi tesne umiestnenými molekulami môžu vytvárať lokálne (nestabilné) usporiadané skupiny obsahujúce niekoľko molekúl. Tento jav sa nazýva objednávka krátkeho dosahu(obr. 3.5.1).
Koeficient β sa nazýva teplotný koeficient objemovej rozťažnosti . Tento koeficient pre kvapaliny je desaťkrát vyšší ako pre tuhé látky. Napríklad pre vodu, pri teplote 20 °C, β v ≈ 2 10 - 4 K - 1, pre oceľ β st ≈ 3,6 10 - 5 K - 1, pre kremenné sklo β kv ≈ 9 10 - 6 K - 1.
Tepelná rozťažnosť vody má pre život na Zemi zaujímavú a dôležitú anomáliu. Pri teplotách pod 4 °C voda expanduje s klesajúcou teplotou (β< 0). Максимум плотности ρ в = 10 3 кг/м 3 вода имеет при температуре 4 °С.
Keď voda zamrzne, roztiahne sa, takže ľad zostane plávať na hladine zamŕzajúcej vodnej plochy. Teplota mraziacej vody pod ľadom je 0°C. V hustejších vrstvách vody pri dne nádrže je teplota okolo 4 °C. Vďaka tomu môže vo vode mrazivých nádrží existovať život.
Väčšina zaujímavá vlastnosť kvapalín je prítomnosť voľný povrch . Kvapalina, na rozdiel od plynov, nevyplní celý objem nádoby, do ktorej sa naleje. Medzi kvapalinou a plynom (alebo parou) sa vytvára rozhranie, ktoré je v porovnaní so zvyškom kvapalnej hmoty v špeciálnych podmienkach. Treba mať na pamäti, že kvôli extrémne nízkej stlačiteľnosti je prítomnosť hustejšieho zbaleného povrchu vrstva nevedie k žiadnej výraznej zmene objemu kvapaliny. Ak sa molekula presunie z povrchu do kvapaliny, sily medzimolekulovej interakcie vykonajú pozitívnu prácu. Naopak, aby bolo možné vytiahnuť určitý počet molekúl z hĺbky kvapaliny na povrch (t.j. zväčšiť povrch kvapaliny), vonkajšie sily musia vykonať pozitívnu prácu Δ A vonkajšie, úmerné zmene Δ S plocha povrchu:
Z mechaniky je známe, že rovnovážne stavy systému zodpovedajú minimálnej hodnote jeho potenciálnej energie. Z toho vyplýva, že voľný povrch kvapaliny má tendenciu zmenšovať svoju plochu. Z tohto dôvodu voľná kvapka kvapaliny nadobúda sférický tvar. Kvapalina sa správa tak, ako keby sily pôsobili tangenciálne k jej povrchu, čím sa tento povrch zmenšuje (sťahuje). Tieto sily sú tzv sily povrchového napätia .
Prítomnosť síl povrchového napätia spôsobuje, že povrch kvapaliny vyzerá ako elastická napnutá fólia, len s tým rozdielom, že elastické sily vo fólii závisia od jej povrchovej plochy (t. j. od toho, ako sa fólia deformuje) a od síl povrchového napätia. nezávisia na povrchu kvapaliny.
Niektoré kvapaliny, ako napríklad mydlová voda, majú schopnosť vytvárať tenké filmy. Všetky známe mydlové bubliny majú správny guľovitý tvar – tým sa prejavuje aj pôsobenie síl povrchového napätia. Ak sa do mydlového roztoku spustí drôtený rám, ktorého jedna strana je pohyblivá, potom sa celý pokryje filmom kvapaliny (obr. 3.5.3).
Sily povrchového napätia majú tendenciu skracovať povrch fólie. Aby sa vyrovnala pohyblivá strana rámu, musí naň pôsobiť vonkajšia sila Ak sa pri pôsobení sily priečka posunie o Δ X, potom dielo Δ A ext = F ext Δ X = Δ Ep = σΔ S, kde ∆ S = 2LΔ X je prírastok plochy povrchu oboch strán mydlového filmu. Keďže moduly síl a sú rovnaké, môžeme písať:
|
Koeficient povrchového napätia σ teda možno definovať ako modul sily povrchového napätia pôsobiacej na jednotku dĺžky čiary ohraničujúcej povrch.
V dôsledku pôsobenia síl povrchového napätia v kvapkách kvapaliny a vo vnútri mydlové bubliny vzniká pretlak Δ p. Ak mentálne odrežeme sférický pokles polomeru R na dve polovice, potom každá z nich musí byť v rovnováhe pri pôsobení síl povrchového napätia aplikovaných na hranicu rezu s dĺžkou 2π R a silu pretlak pôsobiace na plochu π R 2 rezy (obr. 3.5.4). Podmienka rovnováhy sa zapíše ako
Ak sú tieto sily väčšie ako sily vzájomného pôsobenia medzi molekulami samotnej kvapaliny, potom kvapaliny mokrá povrchu pevného telesa. V tomto prípade sa kvapalina približuje k povrchu tuhého telesa pod nejakým ostrým uhlom θ, ktorý je charakteristický pre daný pár kvapalina-tuhá látka. Uhol θ sa nazýva kontaktný uhol . Ak interakčné sily medzi molekulami kvapaliny prevyšujú sily ich interakcie s molekulami pevnej látky, potom sa kontaktný uhol θ ukáže ako tupý (obr. 3.5.5). V tomto prípade sa hovorí, že kvapalina nezmáča sa povrchu pevného telesa. O úplné zmáčanie 0 = 0, at úplné nezmáčanie 6 = 180°.
kapilárne javy nazývaný vzostup alebo pokles tekutiny v rúrkach s malým priemerom - kapiláry. Zmáčavé kvapaliny stúpajú cez kapiláry, nezmáčavé kvapaliny klesajú.
Na obr. 3.5.6 je znázornená kapilára s určitým polomerom r spustená spodným koncom do zmáčacej kvapaliny s hustotou ρ. Horný koniec kapiláry je otvorený. Stúpanie kvapaliny v kapiláre pokračuje dovtedy, kým sa gravitačná sila pôsobiaca na stĺpec kvapaliny v kapiláre nerovná v absolútnej hodnote výslednej F n sily povrchového napätia pôsobiace pozdĺž hranice kontaktu kvapaliny s povrchom kapiláry: F t = F n, kde F t = mg = ρ hπ r 2 g, F n = σ2π r cos θ.
To znamená:
Pri úplnom nezmáčaní je θ = 180°, cos θ = –1, a preto h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
Voda takmer úplne zmáča čistý sklenený povrch. Naopak, ortuť nezmáča povrch skla úplne. Preto hladina ortuti v sklenenej kapiláre klesne pod hladinu v nádobe.
24) Vyparovanie: definícia, druhy (vyparovanie, var), výpočet množstva tepla na vyparovanie a kondenzáciu, merné teplo vyparovania.
Odparovanie a kondenzácia. Vysvetlenie fenoménu vyparovania na základe predstáv o molekulárnej štruktúre hmoty. Špecifické teplo vyparovania. Jej jednotky.
Fenomén premeny kvapaliny na paru sa nazýva odparovanie.
Odparovanie - proces vyparovania prebiehajúci z otvoreného povrchu.
Molekuly kvapaliny sa pohybujú rôznymi rýchlosťami. Ak je akákoľvek molekula na povrchu kvapaliny, môže prekonať príťažlivosť susedných molekúl a vyletieť z kvapaliny. Unikajúce molekuly tvoria paru. Rýchlosti zostávajúcich molekúl kvapaliny sa pri zrážke menia. V tomto prípade niektoré molekuly nadobudnú rýchlosť dostatočnú na to, aby vyleteli z kvapaliny. Tento proces pokračuje, takže kvapaliny sa pomaly vyparujú.
* Rýchlosť odparovania závisí od typu kvapaliny. Tie kvapaliny sa vyparujú rýchlejšie, v ktorých sú molekuly priťahované menšou silou.
*Odparovanie môže nastať pri akejkoľvek teplote. Ale pri vyšších teplotách je odparovanie rýchlejšie .
*Rýchlosť odparovania závisí od jeho povrchu.
*Pri vetre (prúdení vzduchu) dochádza k rýchlejšiemu odparovaniu.
Pri vyparovaní sa vnútorná energia znižuje, pretože. počas odparovania rýchle molekuly opúšťajú kvapalinu, preto priemerná rýchlosť zostávajúcich molekúl klesá. To znamená, že ak nedochádza k prílevu energie zvonku, teplota kvapaliny klesá.
 Fenomén premeny pár na kvapalinu sa nazýva kondenzácii.
Je sprevádzané uvoľňovaním energie.
Fenomén premeny pár na kvapalinu sa nazýva kondenzácii.
Je sprevádzané uvoľňovaním energie.
Kondenzácia pár vysvetľuje vznik oblakov. Vodná para stúpajúca nad zemou vytvára v horných studených vrstvách vzduchu oblaky, ktoré pozostávajú z drobných kvapiek vody.
Špecifické teplo vyparovania - fyzický. veličina udávajúca, koľko tepla je potrebné na premenu kvapaliny s hmotnosťou 1 kg na paru bez zmeny teploty.
Oud. výparné teplo označuje sa písmenom L a meria sa v J / kg
Oud. výparné teplo vody: L=2,3×106 J/kg, alkohol L=0,9×106
Množstvo tepla potrebné na premenu kvapaliny na paru: Q = Lm
Vnútorná energia tela sa môže meniť v dôsledku práce vonkajších síl. Na charakterizáciu zmeny vnútornej energie pri prenose tepla sa zavádza veličina nazývaná množstvo tepla a označovaná Q.
V medzinárodnom systéme je jednotkou množstva tepla, ako aj práce a energie joule: = = = 1 J.
V praxi sa niekedy používa mimosystémová jednotka množstva tepla - kalória. 1 kal. = 4,2 J.
Treba si uvedomiť, že pojem „množstvo tepla“ je nešťastný. Bol zavedený v čase, keď sa verilo, že telá obsahujú nejakú beztiažovú, nepolapiteľnú tekutinu – kalorickú. Proces prenosu tepla údajne spočíva v tom, že kalorické, prelievajúce sa z jedného tela do druhého, nesie so sebou určité množstvo tepla. Teraz, keď poznáme základy molekulárno-kinetickej teórie štruktúry hmoty, chápeme, že v tele nie sú žiadne kalórie, mechanizmus zmeny vnútornej energie tela je iný. Sila tradície je však veľká a naďalej používame termín, zavedený na základe nesprávnych predstáv o povahe tepla. Zároveň by sme pri pochopení podstaty prenosu tepla nemali úplne ignorovať mylné predstavy o ňom. Naopak, nakreslením analógie medzi tokom tepla a tokom hypotetickej kalorickej kvapaliny, množstvom tepla a množstvom kalorií, je možné pri riešení niektorých tried problémov vizualizovať prebiehajúce procesy a správne riešiť problémy. Nakoniec sa na základe nesprávnych predstáv o kalorickom ako nosiči tepla naraz získali správne rovnice popisujúce procesy prenosu tepla.
Pozrime sa podrobnejšie na procesy, ktoré sa môžu vyskytnúť v dôsledku prenosu tepla.
Nalejte trochu vody do skúmavky a uzavrite ju zátkou. Skúmavku zaveste na tyč upevnenú na statíve a priveďte pod ňu otvorený plameň. Z plameňa skúmavka dostáva určité množstvo tepla a teplota kvapaliny v nej stúpa. Keď teplota stúpa, vnútorná energia kvapaliny sa zvyšuje. Dochádza k intenzívnemu procesu jeho odparovania. Expandujúce výpary kvapaliny vykonávajú mechanickú prácu, aby vytlačili zátku z trubice.
Urobme ďalší experiment s modelom dela vyrobeného z kusu mosadznej rúrky, ktorá je namontovaná na vozíku. Na jednej strane je rúrka tesne uzavretá ebonitovou zátkou, cez ktorú prechádza kolík. Drôty sú prispájkované k čapu a rúrke a končia na svorkách, ktoré môžu byť napájané zo siete osvetlenia. Model pištole je teda akýmsi elektrickým kotlom.
 |
Nalejte trochu vody do hlavne dela a uzavrite trubicu gumovou zátkou. Pripojte pištoľ k zdroju napájania. Elektrina, prechádzajúc vodou, ohrieva ju. Voda vrie, čo vedie k jej intenzívnemu odparovaniu. Zvyšuje sa tlak vodnej pary a nakoniec vytlačia korok z hlavne.
Pištoľ sa v dôsledku spätného rázu vráti späť v smere proti korku.
Obe skúsenosti spájajú nasledujúce okolnosti. Počas zahrievania kvapaliny rôzne cesty, teplota kvapaliny a tým aj jej vnútorná energia sa zvýšila. Aby kvapalina vrela a intenzívne sa odparovala, bolo potrebné pokračovať v jej zahrievaní.
Pary kvapaliny vďaka svojej vnútornej energii vykonávali mechanickú prácu.
 |
Skúmame závislosť množstva tepla potrebného na zahriatie telesa od jeho hmotnosti, teplotných zmien a druhu látky. Na štúdium týchto závislostí použijeme vodu a olej. (Na meranie teploty v experimente sa používa elektrický teplomer, vyrobený z termočlánku spojeného so zrkadlovým galvanometrom. Jeden prechod termočlánku sa spustí do nádoby so studenou vodou, aby sa zabezpečila jeho konštantná teplota. Druhý prechod termočlánku meria teplotu skúmanej kvapaliny).
Zážitok pozostáva z troch sérií. V prvej sérii sa pre konštantnú hmotnosť konkrétnej kvapaliny (v našom prípade vody) študuje závislosť množstva tepla potrebného na jej ohrev od zmien teploty. Množstvo tepla prijatého kvapalinou z ohrievača (elektrického sporáka) budeme posudzovať podľa doby ohrevu za predpokladu, že je medzi nimi priamy vzťah. proporcionálna závislosť. Aby výsledok experimentu zodpovedal tomuto predpokladu, je potrebné zabezpečiť stály tok tepla z elektrického sporáka do vyhrievaného telesa. Na tento účel bol elektrický sporák vopred pripojený k sieti, takže na začiatku experimentu sa teplota jeho povrchu prestala meniť. Pre rovnomernejšie zahrievanie kvapaliny počas experimentu ju budeme miešať pomocou samotného termočlánku. Hodnoty teplomera budeme zaznamenávať v pravidelných intervaloch, až kým svetelná škvrna nedosiahne okraj stupnice.
Urobme záver: existuje priama úmernosť medzi množstvom tepla potrebného na zahriatie telesa a zmenou jeho teploty.
V druhej sérii experimentov budeme porovnávať množstvo tepla potrebného na zohriatie rovnakých kvapalín rôznej hmotnosti, keď sa ich teplota zmení o rovnakú hodnotu.
Pre uľahčenie porovnania získaných hodnôt sa hmotnosť vody pre druhý experiment odoberie dvakrát menej ako v prvom experimente.
Opäť budeme v pravidelných intervaloch zaznamenávať hodnoty teplomera.
Porovnaním výsledkov prvého a druhého experimentu môžeme vyvodiť nasledujúce závery.
V tretej sérii experimentov budeme porovnávať množstvá tepla potrebné na zahriatie rovnakých hmôt rôznych kvapalín, keď sa ich teplota zmení o rovnakú hodnotu.
Na elektrickom sporáku si rozohrejeme olej, ktorého hmotnosť sa rovná hmotnosti vody v prvom pokuse. Hodnoty teplomeru budeme zaznamenávať v pravidelných intervaloch.
Výsledok experimentu potvrdzuje záver, že množstvo tepla potrebné na zahriatie telesa je priamo úmerné zmene jeho teploty a navyše naznačuje závislosť tohto množstva tepla od druhu látky.
Keďže v experimente bol použitý olej, ktorého hustota je menšia ako hustota vody a na zahriatie oleja na určitú teplotu bolo potrebné menšie množstvo tepla ako na ohrev vody, možno predpokladať, že množstvo tepla potrebný na zahriatie telesa závisí od jeho hustoty.
Aby sme otestovali tento predpoklad, budeme súčasne ohrievať rovnaké masy vody, parafínu a medi na ohrievači s konštantným výkonom.
Po rovnakom čase je teplota medi asi 10-krát a parafín asi 2-krát vyššia ako teplota vody.
Ale meď má väčšiu a parafín menšiu hustotu ako voda.
Skúsenosti ukazujú, že veličina, ktorá charakterizuje rýchlosť zmeny teploty látok, z ktorých sú vyrobené telesá zapojené do výmeny tepla, nie je hustota. Táto veličina sa nazýva merná tepelná kapacita látky a označuje sa písmenom c.
 |
Na porovnanie špecifických tepelných kapacít rôznych látok sa používa špeciálne zariadenie. Zariadenie pozostáva z regálov, v ktorých je pripevnená tenká parafínová doska a tyč s tyčami, ktoré cez ňu prechádzajú. Na koncoch tyčí sú pripevnené hliníkové, oceľové a mosadzné valce rovnakej hmotnosti.
Na rovnakú teplotu ohrievame valce tak, že ich ponoríme do nádoby s vodou stojacej na rozpálenom elektrickom sporáku. Upevníme horúce valce na stojany a uvoľníme ich z upevňovacích prvkov. Valce sa súčasne dotýkajú parafínovej platne a po roztavení parafínu do nej začnú klesať. Hĺbka ponorenia valcov rovnakej hmotnosti do parafínovej platne, keď sa ich teplota zmení o rovnakú hodnotu, sa ukáže byť odlišná.
Skúsenosti ukazujú, že špecifické tepelné kapacity hliníka, ocele a mosadze sú rôzne.
Po vykonaní zodpovedajúcich experimentov s tavením pevných látok, odparovaním kvapalín a spaľovaním paliva sme získali nasledujúce kvantitatívne závislosti.
Na získanie jednotiek špecifických veličín je potrebné ich vyjadriť z príslušných vzorcov a do výsledných výrazov nahradiť jednotky tepla - 1 J, hmotnosti - 1 kg a pre špecifické teplo - a 1 K.
Získame jednotky: merná tepelná kapacita - 1 J / kg K, ostatné merné teplo: 1 J / kg.
Proces prenosu energie z jedného tela do druhého bez vykonania práce sa nazýva výmena tepla alebo prenos tepla. K prenosu tepla dochádza medzi telesami, ktoré majú rôznu teplotu. Pri nadviazaní kontaktu medzi telesami s rôznymi teplotami sa časť vnútornej energie prenáša z telesa s vyššou teplotou na teleso s nižšou teplotou. Energia odovzdaná do tela v dôsledku prenosu tepla sa nazýva množstvo tepla.
Špecifická tepelná kapacita látky:
Ak proces prenosu tepla nie je sprevádzaný prácou, potom na základe prvého zákona termodynamiky sa množstvo tepla rovná zmene vnútornej energie telesa: .
Priemerná energia náhodného translačného pohybu molekúl je úmerná absolútnej teplote. Zmena vnútornej energie telesa sa rovná algebraickému súčtu zmien energie všetkých atómov alebo molekúl, ktorých počet je úmerný hmotnosti telesa, takže zmena vnútornej energie a následne množstvo tepla je úmerné zmene hmotnosti a teploty:


Faktor úmernosti v tejto rovnici sa nazýva merná tepelná kapacita látky. Merná tepelná kapacita udáva, koľko tepla je potrebné na zvýšenie teploty 1 kg látky o 1 K.
Práca v termodynamike:
V mechanike je práca definovaná ako súčin modulov sily a posunutia a kosínus uhla medzi nimi. Práca sa vykoná, keď sila pôsobí na pohybujúce sa teleso a rovná sa zmene jeho kinetickej energie.
V termodynamike sa neuvažuje o pohybe telesa ako celku, hovoríme o pohybe častí makroskopického telesa voči sebe navzájom. V dôsledku toho sa objem tela mení a jeho rýchlosť zostáva rovná nule. Práca v termodynamike je definovaná rovnako ako v mechanike, ale rovná sa zmene nie kinetickej energie telesa, ale jeho vnútornej energie.
Pri vykonávaní práce (stlačenie alebo expanzia) sa vnútorná energia plynu mení. Dôvod je nasledovný: pri pružných zrážkach molekúl plynu s pohybujúcim sa piestom sa mení ich kinetická energia.
Vypočítajme prácu plynu počas expanzie. Plyn pôsobí na piest silou  , Kde
, Kde  je tlak plynu a
je tlak plynu a  - plocha povrchu
- plocha povrchu  piest. Pri expanzii plynu sa piest pohybuje v smere sily
piest. Pri expanzii plynu sa piest pohybuje v smere sily  na krátku vzdialenosť
na krátku vzdialenosť  . Ak je vzdialenosť malá, tlak plynu možno považovať za konštantný. Práca plynu je:
. Ak je vzdialenosť malá, tlak plynu možno považovať za konštantný. Práca plynu je:
Kde  - zmena objemu plynu.
- zmena objemu plynu.
V procese expanzie plynu vykonáva pozitívnu prácu, pretože smer sily a posunu sa zhodujú. V procese expanzie plyn odovzdáva energiu okolitým telesám.
Práca vykonaná vonkajšími telesami na plyne sa líši od práce plynu iba v znamienkach  , pretože sila
, pretože sila  pôsobiace na plyn je opačné ako sila
pôsobiace na plyn je opačné ako sila  , s ktorým plyn pôsobí na piest a rovná sa mu v absolútnej hodnote (tretí Newtonov zákon); a pohyb zostáva rovnaký. Preto sa práca vonkajších síl rovná:
, s ktorým plyn pôsobí na piest a rovná sa mu v absolútnej hodnote (tretí Newtonov zákon); a pohyb zostáva rovnaký. Preto sa práca vonkajších síl rovná:
 .
.
Prvý zákon termodynamiky:
Prvý zákon termodynamiky je zákon zachovania energie, rozšírený na tepelné javy. Zákon zachovania energie: energia v prírode nevzniká z ničoho a nezaniká: množstvo energie sa nemení, len sa mení z jednej formy na druhú.
V termodynamike sa uvažuje o telesách, ktorých poloha ťažiska sa prakticky nemení. Mechanická energia takýchto telies zostáva konštantná a môže sa meniť iba vnútorná energia.
Vnútornú energiu možno meniť dvoma spôsobmi: prenosom tepla a prácou. Vo všeobecnosti sa vnútorná energia mení tak v dôsledku prenosu tepla, ako aj v dôsledku výkonu práce. Prvý zákon termodynamiky je formulovaný presne pre takéto všeobecné prípady:
Zmena vnútornej energie systému počas jeho prechodu z jedného stavu do druhého sa rovná súčtu práce vonkajších síl a množstva tepla preneseného do systému:

Ak je systém izolovaný, tak sa na ňom nepracuje a nevymieňa si teplo s okolitými telesami. Podľa prvého zákona termodynamiky vnútorná energia izolovaného systému zostáva nezmenená.
Vzhľadom na to  Prvý termodynamický zákon možno napísať takto:
Prvý termodynamický zákon možno napísať takto:

Množstvo tepla preneseného do systému ide na zmenu jeho vnútornej energie a na vykonanie práce na vonkajších telesách systémom.
Druhý zákon termodynamiky: je nemožné preniesť teplo z chladnejšej sústavy do teplejšej pri absencii iných súčasných zmien v oboch sústavách alebo v okolitých telesách.
